Kalia hidroksido
| Kalia hidroksido | |||
 | |||
| Tridimensia strukturo de la Kalia hidroksido | |||
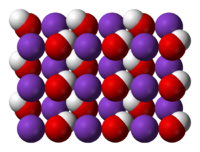
| |||
| Kristala strukturo de Kalia hidroksido | |||

| |||
| Buletoj de Kalia hidroksido | |||
| Alternativa(j) Nomo(j) | |||
| |||
| Kemia formulo | KOH | ||
| PubChem-kodo | 14797 | ||
| ChemSpider kodo | 21106129 | ||
| CAS-numero-kodo | |||
| Fizikaj proprecoj | |||
| Aspekto | blankaj likveskaj unuklinaj kristaloj | ||
| Molmaso | 56.105 g mol−1 | ||
| Denseco | 2.13 g cm−3 | ||
| Refrakta indico | 1,409 | ||
| Fandpunkto | 406 °C (763 ℉; 679 K) | ||
| Bolpunkto | 1327 °C (2,421 ℉; 1,600 K) | ||
| Solvebleco | Akvo:
| ||
| Acideco (pKa) | 13.5 (0.1 M) | ||
| Solvebleco |
| ||
| Mortiga dozo (LD50) | 273 mg/kg (buŝe, muso) | ||
| Sekurecaj Indikoj | |||
| Riskoj | R22 R35 | ||
| Sekureco | (S1/2) S26 S36/37/39 S45 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS etikedigo de kemiaĵoj[1] | |||
| GHS Damaĝo-piktogramo |
| ||
| GHS Signalvorto | Damaĝo | ||
| GHS Deklaroj pri damaĝoj | H302, H314, H318 | ||
| GHS Deklaroj pri antaŭgardoj | P260, P264, P270, P280, P301+330+331, P303+361+353, P304+340, P305+351+338, P310, P330, P363, P405, P501 | ||
(25 °C kaj 100 kPa) | |||
Kalia hidroksido kutime nomata kalia kaŭstikaĵo estas neorganika kombinaĵo, kies kemia formulo estas KOH. Kune kun la Natria hidroksido, ĉi-blanka solido estas prototipo de forta bazo. Ĝi havas multe da industria kaj niĉa aplikoj, kaj la plejmulto el ties aplikoj rilatas al ĝia reakcieco pri acidoj kaj ties koroda naturo.
En 2005, ĉirkaŭ inter 700 mil kaj 800 mil tunoj da kalia hidroksido estis produktitaj. Proksimume centfoje pli da natria hidroksido ol kalia hidroksido estas ĉiujare produktitaj. KOH estas altvalora kiel antaŭanto en la plejmulto de molaj kaj likvaj sapoj, samkiel en sennombraj kemiaĵoj kalihavaj.
Proprecoj kaj strukturo redakti
Kalia hidroksido estas trovebla en pura formo per reakciado de natria hidroksido kun nepura kalio. Kutime kalia hidroksido estas vendata kiel diafanaj buletoj, kiuj iĝas gluecaj ĉe aero ĉar KOH estas higroskopa substanco. Konsekvence, KOH normale enhavas variajn kvantojn da akvo (samkiel karbonatoj). Ĝia dissolviĝo en akvo estas alte varmoeliga, signifante ke la procezo ellasas signifoplenan varmon. Koncentritaj akvosolvaĵoj kelkfoje nomatas potasa lesivo. Eĉ en altaj temperaturoj, solida KOH ne facile senhidratiĝas.
Solvaĵoj kun kalia hidroksido je koncentriĝoj proksimume inter 0.5 kaj 2.0% estas iritaj kiam kontakte kun la haŭto, dum pli altaj koncentriĝoj ol 2% estas korodaj. En pli altaj temperaturoj, solida KOH kristaliĝas laŭ la kristala strukturo de la NaCl. La grupoj OH estas aŭ rapide aŭ hazarde malordigitaj tiel ke la grupo OH− efektive estas ronda anjono kun radiuso 1.53 Å (inter CL− kaj F− laŭ grandeco). Sub la meditemperaturo la grupoj OH− estas ordigitaj kaj la spaco ĉirkaŭ la centroj de la jonoj K+ estas distorditaj, kaj la distancoj inter la jonoj K+ kaj OH− kuŝas inter 2.69 kaj 3.15 Å, depende de la orientigo de la grupo OH−. KOH estigas serion da kristalecaj hidratoj, t. e., la unuhidratoj KOH • 2 H2O, kaj la kvarhidratoj KOH • 4 H2O.
Solvebleco kaj sekigaj proprecoj redakti
Proksimume 121 g de KOH dissolviĝas en 100 mL da akvo laŭ meditemperaturo kompare kun 100 g da NaOH laŭ la sama volumo (surbaze de la molumeco, KOH estas iomete malpli solvebla ol NaOH). Alkoholoj kun malaltaj molekulpezoj tiaj kiaj metanolo, etanolo kaj propanolo same estas bonegaj solvaĵoj.
Pro ties alta afineco kun akvo, KOH servas kiel sekiganto en laboratorio. Ĝi ofte uzatas por sekigi bazajn solvaĵojn, speciale aminojn kaj piridinojn: distiliĝo de ĉi-bazaj likvaĵoj kun suspensiaĵoj de KOH estigas la anhidran reakcianton. Samkiel la NaOH, KOH rivelas termostabilecon[2]. La gasaj specioj estas dimeraj[3][4]. Dank'al ties alta stabileco kaj rilative malalta fandopunkto, ĝi ofte fandatas kiel buletoj aŭ bastonetoj, formoj havantaj malmulte da surfaco kaj konvenajn manipulproprecojn.
Reakcioj redakti
KOH estas alte baza substanco, formante fortajn alkalajn solvaĵojn en akvon kaj en aliajn polarajn solvaĵojn[5]. Ĉi-solvaĵoj estas kapablaj senprotonigi multajn acidojn, eĉ la plej malfortajn. En Analiza Kemio, titradoj uzantaj solvaĵoj de KOH uzatas por acidotesto.
KOH, samkiel NaOH, servas kiel fonto de OH−, iu anjono alte nukleofila[6] kiu atakas la polarajn ligojn, kaj en neorganikaj kaj en organikaj materialoj. Ekzemplo de ties plej konata reakcio eble estas la sapigado aŭ esterigado de akva KOH, laŭ la reakcio:
KOH + RCO2R' → RCO2K + R'OH
Kiam R (radikalo) estas lonĝĉena, la produkto nomatas kalia sapo. Ĉi-reakcio karakteriziĝas pro la grasaspekto, kiun KOH donas kiam tuŝita - grasaĵoj surhaŭte rapide konvertiĝas al sapo kaj glicerolo. Fandita KOH uzatas por dislokigi halogenidojn kaj aliajn reakciantajn grupojn. La reakcio estas ĉefe utila por aromataj reagentoj formantaj la korespondajn fenolojn.
Reakcioj kun neorganikaj kombinaĵoj redakti
Pro ĝia reakcieco rilate al acidoj, KOH atakas oksidojn. Tiamaniere ke, Silicia oksido (SiO2) estas atakita de KOH por estigi kaliajn siliciatojn. KOH reakcias kun karbona duoksido por produkti bikarbonaton:
KOH + CO2 → KHCO3
Manufakturo redakti
Historie KOH estis produktita per aldono de kalia karbonato al forta solvaĵo de kalcia hidroksido (aŭ hidratigita kalko) kondukante al reakcio de duobla ŝanĝo kiu precipitigas la kalcian karbonaton,
Ca(OH)2 + K2CO3 → CaCO3 + 2 KOH
Forfiltrante la precipitigitan kalcian karbonaton kaj forbolante la solvaĵon oni estigas kalian hidroksidon ("kalcinitan aŭ kaŭstikan potason"). Tiu estis la plej grava metodo je produktado de kalia hidroksido ĝis la 19-a jarcento, kiam ĝi estis larĝe substituita de la nuntempa metodo per elektrolizo de solvaĵoj kun Kalia klorido. La procezo estas analoga al la manufakturo de natria hidroksido.
2 KCl + 2 H2O → 2 KOH + Cl2↑ + H2↑
La hidrogena gaso estiĝas kiel flankprodukto en la katodo; samtempe, okazas oksido de la kloro, formante kloran gason kiel kroma produkto. Separado de spacoj inter la anodo kaj la katodo estas esencaj por la bona plenumado de ĉi-procezo.
Uzoj redakti
KOH kaj NaOH povas esti interŝanĝeblaj en serio da aplikoj, tamen, industrie NaOH estas preferebla pro ties malalta kosto. Multaj kaliaj saloj estas preparitaj per neŭtraligaj reakcioj uzantaj KOH-on. La kaliaj saloj el karbonato, cianido, permanganato, fosfato, kaj pluraj aliaj siliciatoj estas preparitaj per traktado kaj de la oksidoj kaj de la acidoj kun KOH. La alta solvebleco de la kalia fosfato favorigas ties uzon kiel sterkoj. Kvankam ĝi estas pli altkosta ol natria hidroksido, KOH estas tre taŭga en la manufakturo de biodizelo per transesterigado de la trigliceridoj en vegetaloleo. Glicerino el biodizelo procezita kun kalia hidroksido estas utila kiel malmultekosta manĝosuplemento por la brutaro, kiam la toksa metanolo estas forigita.
Samkiel natria hidroksido, la kalia hidroksido altiras sennombrajn specialigitajn uzojn, preskaŭ ĉiuj dependantaj de ties proprecoj kiel forta kemibazo krom ties konsekvenca kapablo pri malkompiĝo de multaj materialoj. Ekzemple: en la procezo ordinare nomata kemia kremacio aŭ resomacio[7], kalia hidroksido rapidigas ties malkomponadon de la molaj histoj, kaj bestaj kaj homaj, lasante kiel restaĵo nur la ostojn kaj aliajn malmolajn histojn. Entomologoj kiuj studis la delikatan strukturon de la insekta anatomio uzis akva solvaĵo kun 10% da KOH por aplikado de ĉi-procezo. En kemiaj sintezoj, la elekto inter la uzo de KOH kaj la uzo de NaOH estas determinita per la solvebleco de la rezultanta salo. La korodaj proprecoj de la kalia hidroksido igas ĝin utila ingredienco en la preparaĵoj kiuj disinfektas kaj purigas surfacojn kaj materialojn kiuj estas rezisteblaj al la korodaj efektoj de la KOH.
KOH estas ankaŭ uzata en la fabrikado de duonkondukaj integraj cirkvitoj. Kalia hidroksido ofte estas la ĉefa ingredienco por kemiaj "kutiklaj forigiloj" uzataj en manikura traktado. Pro la agresiveco de la kemiaj bazoj, samkiel KOH, kiuj povas damaĝi la eksteran parton de la fadenharo, kalia hidroksido uzatas kiel kemia helpilo por hararforigo el bestohaŭtoj. La bestohaŭtoj plurhore estas sapigitaj en solvaĵo da KOH kaj akvo por preparado de la senhariga staĝo de la tanadprocezo. La sama rimedo same uzatas por malfortigi la homharon dum razado. Antaŭrazaj produktoj kaj kelkaj razkremoj enhavas kalian hidroksidon por devigi ke la harfadeno moliĝu kaj aktivu kiel higroskopa aganto por altiri kaj enigi akvon en la harradiko, kaŭzante postajn damaĝojn al la vangharo. Dum ĉi tiu malfortiĝinta stato, la vangoharo estas pli facile razebla pere de razklingo. Kalia hidroksido uzatas por identigi kelkajn speciojn da fungoj. Akva solvaĵo kun 3%-5% da kalia hidroksido aplikatas al la fungohaŭto kaj la esploristo rimarkas eblajn ŝanĝokolorojn. Kelkaj specioj da fungoj samkiel Agarikaloj, boletoj, poliporoj kaj likenoj estas identigitaj laŭ ties reakcio kun ŝanĝokoloro. Kalia hidroksido uzatas en petrola kaj naturgasa rafinado por elimino de organikaj acidoj kaj sulfuraj kombinaĵoj .
Manufakturo de molsapoj redakti
La sapigado de grasoj kun KOH uzatas por prepari la korespondan "kaliajn sapojn", kiuj estas pli molaj ol la ordinaraj sapoj faritaj kun natria hidroksido. Pro ĝia moleco kaj pli granda solvebleco, la kaliaj sapoj necesas malpli da akvo por likviĝi, kaj tiam ili povas enteni pli da purigagento ol la likvigitaj natrisapoj. Akva kalia hidroksido uzatas kiel elektrolito en alkalaj piloj surbaze de nikelo-kadmio, nikelo-hidrogeno kaj mangana dioksido-zinko. Kalia hidroksido estas preferebla anstataŭ natria hidroksido ĉar ties solvaĵoj estas pli konduktivaj. La piloj kun nikelo-hidrogena metalo de la Toyota Prius uzas miksaĵon da kalia hidroksido kaj natria hidroksido. La pikoj surbaze de nikelo-fero same uzas kalihidroksida elektrolito.
Saloj redakti
Literaturo redakti
- Chemical Book
- TheChemicalBlog Arkivigite je 2015-04-29 per la retarkivo Wayback Machine
- Sodium Hydroxide Arkivigite je 2015-05-02 per la retarkivo Wayback Machine comparison
- Chemistry Explained
- A Comprehensive Guide to the Hazardous Properties of Chemical Substances, Pradyot Patnaik
- Chemistry, John Daintith
- Concise Encyclopedia Chemistry, Mary Eagleson
- A Text Book of Inorganic Chemistry, Anil Kumar De
- The Facts on File Dictionary of Inorganic Chemistry, John
Daintith
- Industrial Inorganic Chemistry, Karl Heinz Büchel, Hans-Heinrich Moretto, Dietmar Werner
- A Comprehensive Guide to the Hazardous Properties of Chemical Substances, Pradyot Patnaik
- A Laboratory History of Chemical Warfare Agents, Jared Ledgard
- Dictionary Of Chemistry, N. Pradeep Sharma
- Heat Treating: Including Advances in Surface Engineering, an ..., Volume 1, Kiyoshi Funatani, George E. Totten
- Paint Technology Handbook, Rodger Talbert
- Alkali and Alkaline Earth Metals, Volume 2, Monica Halka, Brian Nordstrom
- Chest of Books
- The Little Black Book of Gastroenterology, David W. Hay
- Medline Plus
- Creation Wiki, Encyclopedia of Creation Science
- Centroj por Kontrolo kaj Preventado de Malsanoj
- Chemistry in Its Element - Potassium Arkivigite je 2016-03-06 per la retarkivo Wayback Machine
- Science with Ryan
Prezentaĵoj de Youtube redakti
- Titration of Cheap Potassium Hydroxide
- Sodium hydroxide and Potassium hidroxide
- Making Liquid Soap With KOH
- How-To Make Potassium Hydroxide
- Make Potassium manganate K2MnO4 (Termo-malkomponiĝo de KMnO4)
Vidu ankaŭ redakti
-
Kalia karbonato
Referencoj redakti
- ↑ LabChem
- ↑ Advanced Chemistry, Michael Clugston, Rosalind Flemming
- ↑ Dimeroj estas kunaĵo de du molekuloj.
- ↑ Organic Chemistry, Marye Anne Fox, James K. Whitesell
- ↑ Advanced Organic Chemistry: Part A: Structure and Mechanisms, Francis A. Carey, Richard J. Sundberg
- ↑ Nukleofila estas kemia specio kiu donas elektronparo al elektrofilo, formante kemian ligon rilate al la reakcio.
- ↑ Resomacio aŭ alkala kremacio estas kadavroelimina procezo pere de la korpomergo en fortan kemian bazon, sub alta premo kaj temperaturo kondukante al ties dissolviĝo.




