Kalia kvartionato
kemia kombinaĵo
| Kalia kvartionato | |||
 | |||
| Plata kemia strukturo de la Kalia kvartionato | |||
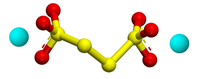 | |||
| Tridimensia kemia strukturo de la Kalia kvartionato | |||
| Alternativa(j) nomo(j) | |||
| |||
| Kemia formulo | |||
| CAS-numero-kodo | 13932-13-3 | ||
| ChemSpider kodo | 55604 | ||
| PubChem-kodo | 61701 | ||
| Fizikaj proprecoj | |||
| Aspekto | flava solido | ||
| Molmaso | 302,431 g·mol−1 | ||
| Denseco | 2,96g cm−3 | ||
| Solvebleco | Akvo:232 g/L [1] | ||
| Mortiga dozo (LD50) | 1980 mg/kg (buŝe) | ||
| Sekurecaj Indikoj | |||
| Riskoj | R36/37/38 | ||
| Sekureco | S26 S36 S37/39 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS Damaĝo Piktogramo |
| ||
| GHS Signalvorto | Averto | ||
| GHS Deklaroj pri damaĝoj | H315, H319, H335 | ||
| GHS Deklaroj pri antaŭgardoj | P261, P264, P271, P280, P302+352, P304+340, P305+351+338, P312, P321, P332+313, P337+313, P362, P403+233, P405, P501[2] | ||
(25 °C kaj 100 kPa) | |||
Kalia kvartionato aŭ K2S4O6 estas neorganika okso-kombinaĵo de kalio kaj sulfuro, flaveca substanco apartenanta al la familio de la tionataj acidoj kun du, tri, kvar kaj kvin sulfuratomoj. Kalia kvartionato formiĝas per oksidado de kalia tiosulfato kaj likva jodo, kies salo rezultanta povas izoliĝi el la solvaĵo per frakcia kristaliĝo. Ĝi posedas mikrobiocidajn kaj fungicidajn proprecojn kaj estas forta reduktagento kaj antioksidiganto. Laŭŝajne kvartionatoj kaj aliaj sulfuraj derivaĵoj posedas neŭtraligajn efikojn sur enterobakterioj, fungoj kaj streptokokoj.
Sintezoj redakti
Sintezo 1 redakti
- Jodo oksidigas solvaĵojn de kalia tiosulfato al kalia kvartionato. Tiu reakcio estas uzata en titradoj en volumetriaj analizoj[3]:
|
|
Sintezo 2 redakti
- Interago de dusulfura duklorido kaj kalia sulfito[4]. Ĉi-reakcio estis priskribita en 1942 far Stamm kaj Göhring:
|
|
Sintezo 3 redakti
- Kvintionatoj reakcias kun bromo donante kvartionatojn:
|
|
Sintezo 4 redakti
- Alternativa preparado povas esti interagado de duklorido de dusulfurilo, sulfura duoksido neŭtraligitaj per kalia hidroksido:
|
|
Reakcioj redakti
Reakcio 1 redakti
- Tritionatoj povas esti preparataj per reakcio inter kvartionatoj kaj sulfitoj[4]:
|
|
Reakcio 2 redakti
- Per varmigo, kvartionato de kalio malkomponiĝas en tritionaton de kalio kaj kvintionaton de kalio:
|
|
Reakcio 3 redakti
- Oksidigagentoj tiaj kiaj kloro igas kvartionatojn en sulfatojn. H. Debus elmontris ke bromo-akvo laŭgrade aldonita al solvaĵoj de kvartionatoj rezultas en separado de sulfuro[5]:
|
|

