Malonata acido
| Malonata acido | |||
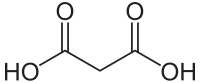
| |||
| Plata kemia strukturo de la Malonata acido | |||

| |||
| Tridimensia strukturo de la Malonata acido | |||
| Alternativa(j) nomo(j) | |||
| Kemia formulo | |||
| CAS-numero-kodo | 141-82-2 | ||
| ChemSpider kodo | 844 | ||
| PubChem-kodo | 867 | ||
| 14,5710 | |||
| Fizikaj proprecoj | |||
| Aspekto | senkoloraj kristaloj aŭ kristaleca pulvoro, sublimiĝas en vakuo | ||
| Molmaso | 104.062 g·mol−1 | ||
| Denseco | 1.619 g cm−3 | ||
| Mortiga dozo (LD50) | 1310 mg/kg | ||
| Fandpunkto | inter 135 kaj 137 °C (inter 275 kaj 279 ℉; inter 408 kaj 410 K) (malkomponiĝas) | ||
| Bolpunkto | malkomponiĝas | ||
| Ekflama temperaturo | 33.33 °C (91.99 ℉; 306.48 K) | ||
| Refrakta indico | 1,479 | ||
| Solvebleco | Akvo:Tute solvebla en akvo, alkoholo kaj etero | ||
| Sekurecaj Indikoj | |||
| Risko | R22 R36 | ||
| Sekureco | S26 S28 S37/39 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS etikedigo de kemiaĵoj[1] | |||
| GHS Damaĝo-piktogramo |
| ||
| GHS Signalvorto | Damaĝo | ||
| GHS Deklaroj pri damaĝoj | H302, H316, H318, H333 | ||
| GHS Deklaroj pri antaŭgardoj | P280, P305+351+338, P310 | ||
(25 °C kaj 100 kPa) | |||
Malonata acido aŭ propanodioata acido estas dukarboksilata acido kies derivitaj saloj kaj esteroj estas konataj kiel malonatoj. La nomo devenas el la greka vorto "μᾶλον" (malon) kies signifo estas pomo.
La malonata acido kaj ĝiaj esteroj karakteriziĝas pri vasta gamo da kondensiĝaj produktoj. Ili estas gravaj perantoj en la sintezo de la vitaminoj B1 kaj B6, barbituratoj, Nesteroidaj kontraŭinflamaj drogoj (aŭ NSAIDs), agrokemiaĵoj, gustigaj kaj odordonaj komponaĵoj.
Proprecoj redakti
Malonata acido estas blanka, kristaleca substanco, tre solvebla en akvo, alkoholoj kaj eteroj, stabila sub ordinaraj kondiĉoj je temperaturo, premo kaj konserviĝo, kaj facile malkomponiĝas per hejtado. La akva solvaĵo estas inter milde kaj forte acida. Malonata acido ne estas akordigebla kun oksidigagentoj, reduktagentoj kaj bazoj.
Ĝi estas nek toksa en la aero, nek danĝera por mara kaj surtera transportadoj. Malonato de hidrogeno kelkfoje uzatas dum traktado de ostoporozo en viroj.[2] Unu el la derivaĵoj de la malonata acido, ekzemple, la cinamata acido estiĝas per kondensiĝa reakcio inter la benzaldehido kaj la malonata acido en piridina medio.
Historio redakti
La malonata acido estis unue estigita en 1858 de la franca kemiisto Victor Dessaignes (1800-1885) pere de oksidigo de la malikata acido kun kalia dukromiato. La malikata acido estis unue izolita el la pomsuko far Carl Wilhelm Scheele, en 1785, kiu pli malfrue ricevis tiun nomon de Lavoisier.
En 1836, Théophile-Jules Pelouze izolis la maleatan acidon kaj en 1838 Justus von Liebig malkovris la empiriajn formulojn de la fumarata kaj maleata acidoj, kvankam Liebig kredis ke la pli alta fando-punkto de la fumarata acido estis pro tio ke ĝi estis polimero de la maleata acido. August Kekulé sukcesis redukti ambaŭ acidojn al sukcenata acido hejtante ĉiu el ili kun jodida acido kaj ankaŭ per agado de natria amalgamo en solvaĵoj de la respektivaj acidoj.
Literaturo redakti
- Organic Chemistry, Marye Anne Fox, James K. Whitesell
- Advanced Organic Chemistry: Reaction Mechanisms, Reinhard Bruckner
- Chemical Demonstrations: A Handbook for Teachers of Chemistry, Bassam Z. Shakhashiri
- Organic Chemistry, William Brown, Christopher Foote, Brent Iverson, Eric Anslyn
- Plant Cell Biology: From Astronomy to Zoology, Randy O. Wayne
- Chemical Book
- Chemicalland21
- Encyclopaedia Britannica[rompita ligilo]
- Cameo Chemicals
Vidu ankaŭ redakti
- Okzalata acido
- Sukcenata acido
- Fumarata acido
- Victor Dessaignes (1800-1885)
- Théophile-Jules Pelouze (1807-1867)
- Carl Wilhelm Scheele (1742-1786)
Kunrilataj kemiaĵoj redakti
Referencoj redakti
- ↑ Sigma Aldrich Arkivigite je 2014-09-26 per la retarkivo Wayback Machine
- ↑ Drug bank



