Fosfora pentafluorido: Malsamoj inter versioj
kemia kombinaĵo
Enhavo forigita Enhavo aldonita
Nova paĝo kun '{{Tabela informkesto|Informkesto kemia substanco}} {| class="wikitable floatright" width=10% |-style="background: green; color: white" |colspan="2" style="text-align: center;"|<b...' |
(Neniu diferenco)
|
Kiel registrite je 21:50, 10 dec. 2018
| Fosfora kvinfluorido | ||||
 | ||||
| Plata kemia strukturo de la Fosfora kvinfluorido | ||||
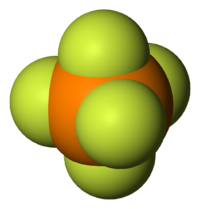 | ||||
| Tridimensia kemia strukturo de la Fosfora kvinfluorido | ||||
| Alternativa(j) nomo(j) | ||||
| ||||
| Kemia formulo | ||||
| CAS-numero-kodo | 7647-19-0 | |||
| ChemSpider kodo | 22715 | |||
| PubChem-kodo | 24295 | |||
| Merck Index | 15,7464 | |||
| Fizikaj proprecoj | ||||
| Aspekto | senkolora, nebrulema, koroda, termo-stabila, fumiganta gaso kun malagrabla penetranta odoro | |||
| Moluma maso | 125,966 g·mol-1 | |||
| Denseco | 5,527g cm−3 | |||
| Fandpunkto | -93,8°C | |||
| Bolpunkto | -75°C | |||
| Ekflama temperaturo | -84,6 °C[1] | |||
| Solvebleco | Akvo:reakcias | |||
| Sekurecaj Indikoj | ||||
| Riskoj | R26 R35 [2] | |||
| Sekureco | S9 S26 S36/37/39 S45 | |||
| Pridanĝeraj indikoj | ||||
| Danĝero
| ||||
| GHS Damaĝo Piktogramo |
| |||
| GHS Signalvorto | Damaĝa | |||
| GHS Deklaroj pri damaĝoj | H280, H314, H330 | |||
| GHS Deklaroj pri antaŭgardoj | P260, P264, P271, P280, P284, P301+330+331, P303+361+353, P304+340, P305+351+338, P310, P320, P321, P363, P403+233, P405, P410+403, P501[3] | |||
(25 °C kaj 100 kPa) | ||||
Fosfora kvinfluorido aŭ PF5 estas neorganika kombinaĵo de fosforo kaj fluoro, senkolora, nebrulema, koroda, termo-stabila, fumiganta gaso kun malagrabla penetranta odoro, uzata kiel potenca, oksidiga kaj fluorigagento en kemiaj sintezoj. Kvinfluorido de fosforo estis malkovrita en jaro 1876 de la brita kemiisto Thomas Edward Thorpe (1845-1925), verkinto de ia Historio pri kemio (1910). [4]
| Struktura simileco | |||
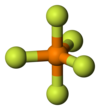
|

| ||
| Pro la simileco de molekulaj strukturoj, silicia kvarfluorido, fosfora kvinfluorido kaj sulfura heksafluoro estas alte volatilaj substancoj.[5] | |||
Sintezoj
Sintezo 1
- Preparado per reakcio inter fosfora kvinklorido kaj arsena trifluorido:[6]
Sintezo 2
- Per interagado de [[fosfora kvinklorido kaj kalcia fluorido:
|
2 +2 2 +5kalcia klorido |
Sintezo 3
- Per traktado de fosfora kvinklorido kun fluorida acido:
Sintezo 4
- Per reakcio inter fosfora kvinklorido kaj zinka fluorido:
Sintezo 5
- Per interagado de fosfora kvinklorido kun natria fluorido:
Sintezo 6
- Metodo de Henri Moissan (1852-1907) kreita en 1886: Reakcio inter fosfora trifluorido kaj bromo formante la adukton fosfora trifluoro-dubromido. Poste, per malkomponado la antaŭa komponaĵo iĝas en fosfora kvinfluorido kaj fosfora kvinbromido:
|
5 +5 5 +3 +2fosfora kvinbromido |
Sintezo 7
- Per malkomponado de fosfora trifluorido:
Sintezo 8
- Per traktado de fosfora trifluorido] kun fluoro:
Sintezo 9
- Per agado de sulfura trioksido sur fosforila fluorido kaj fluorida acido:
Sintezo 10
- Per agado de fosforila fluorido sur natria fluorido:
|
+2 +natria oksido |
Sintezo 11
- Per interagado de nitrila fluorido kaj fosfino:
|
10 +2fosfino meu arquivo 2 +10 +3 |
Sintezo 12
- Per traktado de fosfora kvinoksido kun kalcia fluorido:
Reakcioj
Reakcio 1
- Malkomponado de fosfora kvinfluorido:
Reakcio 2
- Hidrolizo per formado de fosforila fluorido kaj fluorida acido:
Reakcio 3
- Kiam hidrolizo okazas per eksceso da akvo fosfata acido estiĝas:
Reakcio 4
- Reakcio de fosfora kvinfluorido kun natria hidroksido:
Reakcio 5
- Reakcio de fosfora kvinfluorido kun silicia oksido:
|
2 +silicia oksido 2 + |
Reakcio 6
- Preparado de kompleksaĵo natria fosfora-heksafluorido:
Reakcio 7
- Nitroniuma heksafluoro-fosfato estiĝas per reakcio inter fosfora kvinfluorido, nitrata acido kaj klorida acido:[7]
Reakcio 8
- Sintezo de fluorometano per interagado de fosfora kvinfluorido kaj metanolo:
Reakcio 9
- Preparado de dufluorofosfata acido per agado de fosfora kvinflorido kaj sulfuro en akva medio:
|
2 +4 +3 2dufluoro-fosfata acido+2 + |
Reakcio 10
- Preparado de litia heksafluoro-fasfato per traktado de fosfora kvinfluorido kaj litia fluorido:[8]
Reakcio 11
- Sintezo de natria heksafluorofosfato per agado de fosfora kvinfluorido kaj natria hidroksido:
Reakcio 12
- Sintezo de silicia kvarfluorido per traktado de fosfora kvinfluorido kaj silicia kvaroksido en akva medio:




