Natria tiosulfato
| Natria tiosulfato | |||
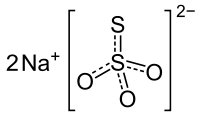
| |||
| Kemia strukturo de la Natria tiosulfato | |||

| |||
| 3D Kemia strukturo de la Natria tiosulfato | |||

| |||
| Blankaj kristaloj de natria tiosulfato | |||
| Alternativa(j) nomo(j) | |||
| |||
| Kemia formulo | |||
| CAS-numero-kodo |
| ||
| ChemSpider kodo | 22885 | ||
| PubChem-kodo | 24477 | ||
| Fizikaj proprecoj | |||
| Aspekto | Blankaj senodoraj kristaloj | ||
| Molmaso |
| ||
| Denseco | 1,667 g/cm3 | ||
| Refrakta indico | 1,489 | ||
| Fandopunkto | 48.3 °C (118.9 ℉; 321.4 K) (kvinhidrata) | ||
| Bolpunkto | 100 °C (212 ℉; 373 K) (kvinhidrata, - 5 H2O malkomponiĝo) | ||
| Solvebleco | |||
| Ekflama temperaturo | Ne bruliva | ||
| Nutro-aldonaĵo | E539 | ||
| Sekurecaj Indikoj | |||
| Risko | R35 R36/37/38 | ||
| Sekureco | S26 S36 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS etikedigo de kemiaĵoj | |||
| GHS Damaĝo-piktogramo |
| ||
| GHS Signalvorto | Damaĝa substanco | ||
| GHS Deklaroj pri damaĝoj | H242, H302 | ||
| GHS Deklaroj pri antaŭgardoj | P270, P304+312, P304+340, P305+351+338 | ||
(25 °C kaj 100 kPa) | |||
Natria tiosulfato, tiosulfato de natrio aŭ Na2S2O3 estas neorganika kombinaĵo de natrio kaj tiosulfata acido, ĝenerale trovata en ĝia formo kvinhidrata. Ĉi-blanka salo estas efloreska (facile perdas akvon) kiu bone dissolviĝas en akvo. Ĝi konsideratas antidoto kontraŭ cianida kaj arsena venenado, kaj uzatas kun proprecoj antioksida kaj antimaljuniga.
Strukturo redakti
Du polimorfoj estas konataj de la kvindrata natria tiosulfato. La anhidra salo ekzistas en pluraj polimorfoj. En solida stato, la tiosulfata anjono estas kvaredra laŭ formato kaj teorie ĝi derivas per anstataŭado de oksigenatomoj per sulfuratomoj en la sulfata anjono. La distanco inter la sulfuratomoj S-S indikas simplan ligon, implicante ke la fina sulfuro enportas fortan negativan ŝarĝon kaj la S-O interagoj havas pli da karaktero de duobla ligo.
Sintezoj redakti
Sintezo 1 redakti
- En laboratorio ĝi estiĝas per reakcio inter natria sulfito kaj sulfuro:
|
|
Sintezo 2 redakti
- aŭ bolante sulfura duoksido, sulfida acido kaj natria hidroksido:
|
|
Sintezo 3 redakti
- Per traktado de natria hidroksido kaj sulfuro
|
|
Sintezo 4 redakti
- Pura natria tiosulfato prepareblas per reakcio de sulfuro kaj natria nitrito en formiamido, ĉi-reakcio okazas sub temperaturo de 80 °C dum 30 minutoj:
|
|
Sintezo 5 redakti
- Per dissolvado de natria sulfido en akvo kaj oksigeno:
|
|
Reakcioj redakti
Reakcio 1 redakti
- Natria sulfato malkomponiĝas sub alta temperaturo:
|
|
Reakcio 2 redakti
- Kiel forta reduktagento, en la ĉeesto de kloro, natria tiosulfato oksidiĝas al sulfata acido:
|
|
Reakcio 3 redakti
- Natria tiosulfato reakcias kun sulfata acido estigante sulfatojn:
|
|
Reakcio 4 redakti
- Natria tiosulfato reakcias kun klorida acido malkomponiĝante en kloreto, sulfuron, akvon kaj sulfuran duoksidon:
|
|
Kloraminoj redakti
- Natria tiosulfato suferas la jenajn reakciojn kun unukloraminoj[1]:
Reakcio 5 redakti
- Troo da unukloramino:
|
|
Reakcio 6 redakti
- Pli diluitaj reakciantoj:
|
|
Reakcio 7 redakti
- Troo da natria tiosulfato
|
|
Dukloraminoj redakti
- Natria tiosulfato suferas la jenajn reakciojn kun dukloraminoj:
Reakcio 8 redakti
- Troo da dukloramino:
|
|
Reakcio 9 redakti
- Diluitaj reakciantoj:
|
|
Reakcio 10 redakti
- Natria tiosulfato koncentrita:
|
|
Jodometrio redakti
En analiza kemio, la plej grava uzo de natria tiosulfato okazas pro tio ke la tiosulfata anjono reakcias stekiometrie kun Jodo en akvosolvaĵo, reduktante ĝin al jodo same kiel ĝi oksidiĝas al kvartionato:
- En la ĉeesto de malpli fortaj oksidantoj, kiel jodo, natria tiosulfato transformiĝas en natria kvartionato:
Pro la kvanta karakter de ĉi-reakcio, same kiel pro tio ke Na2S2O3 . 5 H2O havas bonegan vivodaŭron, ĝi uzatas kiel titranto en jodometrio. Na2S2O3 . 5 H2O ankaŭ estas komponanto de la eksperimento kun tempomezuro de la jodo[2].
Ĉi-specifa eksperimento povas esti uzata por mezuri la oksigeno-enhavon de la akvo pere de longa serio da reakcioj laŭ la "Testo Winkler por dissolvita oksigeno"[3]. Ĝi same uzatas por taksi la kloro-enhavo en komerca blankiganta pulvoro kaj akvo.
Literaturo redakti
- Water Chlorination and Chloramination Practices and Principles, 2nd Ed. (M20), AWWA Staff
- Food Chemicals Codex, Institute of Medicine (U.S.). Committee on Food Chemicals Codex
- The International Pharmacopoeia, Volume 1, World Health Organization
- Experiments in General Chemistry: Inquiry and Skill Building, Vickie Williamson, Larry Peck
- Classic Chemistry Experiments, Kevin Hutchings
- Sigma Aldrich
- General Chemistry online
- Clinical Journal of the American Society of Nephrology
YouTube redakti
Referencoj redakti
- ↑ Guidance Manual for Disposal of Chlorinated Water, Maria Tikkanen
- ↑ Incredible Chemical Reaction!
- ↑ Wildland Water Quality Sampling and Analysis, John D. Stednick



