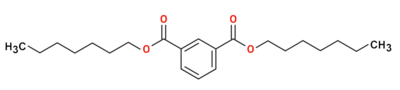
Heptila izoftalato
| Heptila izoftalato | ||
 | ||
Heptila izoftalato | ||
 | ||
| Alternativa(j) nomo(j) | ||
| ||
| Kemia formulo | ||
| Fizikaj proprecoj | ||
| Molmaso | 362,51g mol−1 | |
| Denseco | 0,992 g/cm−3 | |
| Bolpunkto | 357 °C | |
| Ekflama temperaturo | 213 °C | |
| Solvebleco | Akvo:nesolvebla
- style="background: yellow; color: black" | |
| GHS etikedigo de kemiaĵoj | ||
| GHS Damaĝo Piktogramo |
| |
| GHS Signalvorto | Averto | |
| GHS Deklaroj pri damaĝoj | H360, H400 | |
| GHS Deklaroj pri antaŭgardoj | P264, P270, P280, P301+312, P302+352, P305+351+338, P321, P330, P332+313, P337+313, P362, P501 | |
(25 °C kaj 100 kPa) | ||
Heptila izoftalato aŭ C22H34O4 estas kemia komponaĵo, apartenanta al la funkcia grupo de la esteroj de la izoftalata acido kaj heptanolo. Heptila izoftalato estas kemia reakciaĵo, uzata en la fabrikado de izoftalata acido derivaĵoj kaj n-heptilaj derivaĵoj kaj en la produktado de plastaĵoj. Kutime ĝi estiĝas per kondensiĝa reakcio aŭ per esterigo de Fischer-Speyer kun sulfata acido kiel katalizilo. Heptila izoftalato estas malmulte solvebla en akvo, sed tre solvebla en alkoholo, duetila etero, kloroformo kaj plejmulto el la organikaj solvantoj. Heptila izoftalato reakcias kun fortaj oksidigagentoj kaj fortaj bazoj kaj posedas antifungajn kaj antibakteriajn proprecojn.
Sintezoj
redaktiReakcio 1
redakti- Preparado de heptila izoftalato per interagado de izoftalata acido kun heptila alkoholo:
Reakcio 2
redakti- Preparado de heptila izoftalato per interagado de izoftaloila duklorido kun heptila alkoholo:
Reakcio 3
redakti- Preparado de heptila izoftalato per interagado de heptila klorido kun izoftalata acido:
Reakcio 4
redakti- Preparado de heptila izoftalato per interagado de heptila klorido kun natria izoftalato:
Reakcio 5
redakti- Varma malkomponado de izoftalatoj: Ĉe pli altaj temperaturoj ol 450°C, senkarboksiliga procezo komenciĝas kun formado de karbona duoksido, benzoata acido kaj benzeno.[1]. Eventuale la restantaj hidrokarbonidoj oksidiĝos al karbona duoksido kaj akvo.
