Kalia hiponitrito
kemia kombinaĵo
| Kalia hipo-nitrito | ||||
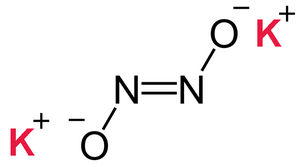 | ||||
| Plata kemia strukturo de la Kalia hipo-nitrito | ||||
 | ||||
| Tridimensia kemia strukturo de la Kalia hipo-nitrito | ||||
| Alternativa(j) nomo(j) | ||||
| ||||
| Kemia formulo | ||||
| Fizikaj proprecoj | ||||
| Molmaso | 138.2088 g·mol−1 | |||
| Sekurecaj Indikoj | ||||
| Riskoj | R9 R20 R21 R22 R44 | |||
| Sekureco | S14 S16 S27 S36 S37 | |||
| Pridanĝeraj indikoj | ||||
| Danĝero
| ||||
| GHS Damaĝo Piktogramo |
| |||
| GHS Signalvorto | Damaĝa substanco | |||
| GHS Deklaroj pri damaĝoj | H300, H302, H315 | |||
| GHS Deklaroj pri antaŭgardoj | P101, P102, P103, P202, P270 | |||
(25 °C kaj 100 kPa) | ||||
Kalia hipo-nitrito aŭ K2N2O2 estas neorganika komponaĵo, malstabila senkolora substanco, kies derivaĵo, la hiponitrita acido estas produktata per reakcio kun forta acido en etera medio. Kutime, la metalaj saloj de la hiponitrita acido estiĝas per reduktado de kalia/hidrarga amalgamo kaj kalia nitrato. Aliflanke, metala kalio povas diseriĝi en solvaĵo de piridino sub hidrogena atmosfero. La kalia-piridina adukto povas agi kiel reduktagento rilate al la nitrata oksido[1]:
Hiponitritoj estas substancoj enhavantaj anjonon [ON=NO]2- kaj la acidaj hiponitriloj enhavas la anjonon [HON=NO]-.
Sintezoj
redaktiSintezo 1
redakti- Kalia hiponitrito prepareblas per reduktado de koncentrita varma solvaĵo de kalia nitrato kaj kalia-hidrarga amalgamo[2]:
|
|
Sintezo 2
redakti- Ĝi estiĝas per oksidigo de koncentrita hidroksilamino kaj Kalia nitrito en alkala medio:
|
|
Sintezo 3
redakti- Neŭtraligo de hiponitrita acido kaj kalia hidroksido:
|
|
Sintezo 4
redakti- Pere de alkohola solvaĵo kun kalia nitrito kaj amalgamo de kalio kaj hidrargo:
|
|
Sintezo 5
redakti- Sammaniere, amalgamoj de magnezio kaj hidrargo fandiĝas kun nitratoj por doni hiponitritojn en akva medio[1]:
|
|
Reakcioj
redaktiReakcio 1
redakti- Kalia hiponitrito komplete malkomponiĝas sub agado de la koncentrita sulfata acido. La reakcio estas eksploda kaj liberigas nitrozan oksidon[3]:
|
|
Reakcio 2
redakti- Ĝi estas atakata de koncentrita klorida acido:
|
|
Reakcio 3
redakti- Dum pasado de klorida acido tra glacia solvaĵo de kalia hiponitrito, hiponitrita acido estiĝas:
|
|
Reakcio 4
redakti|
|
Reakcio 5
redakti- Oksidado de jodo al jodida acido:
|
|
Reakcio 6
redakti- Duobla interŝanĝa reakcio inter kalia hiponitrito kaj arĝenta nitrato:
|
|
Reakcio 7
redakti- Ĝi reakcias kun karbona duoksido:
|
|
Literaturo
redaktiReferencoj
redakti- ↑ 1,0 1,1 The Chemistry of Nitrogen
- ↑ The Chemistry of Lithium, Sodium, Potassium, Rubidium, Cesium and Francium ..., William A. Hart,O. F. Beumel,Thomas P. Whaley
- ↑ Coherent Synchronized Oxidation Reactions by Hydrogen Peroxide
- ↑ Ĝenerale atomaj hidrogenoj estiĝas per reakcio inter forta acido kaj metalo kiu dislokigas hidrogenon el acidoj.




![{\displaystyle {2\,K+2\,NO{\xrightarrow[{piridino}]{benzeno}}K_{2}N_{2}O_{2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cdc5d74e2ab493137d30d520106c6214f5a45fa6)