Bromoacetata acido
| Bromoacetata acido | ||||
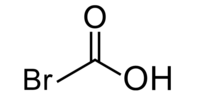
| ||||
| Kemia strukturo de la Bromoacetata acido | ||||

| ||||
| 3D Kemia strukturo de la Bromoacetata acido | ||||
| Kemia formulo | ||||
| CAS-numero-kodo | 79-08-3 | |||
| ChemSpider kodo | 10301338 | |||
| PubChem-kodo | 6227 | |||
| Fizikaj proprecoj | ||||
| Aspekto | Blanka aŭ flava kristala solido | |||
| Molmaso | 138.95 g mol−1 | |||
| Denseco | 1,934 g/cm3 | |||
| Refrakta indico | 1,4804 | |||
| Fandopunkto | inter 49 kaj 51 °C | |||
| Bolpunkto | inter 206 kaj 208 °C | |||
| Solvebleco | Akvo:960 g/l (20 °C) | |||
| Solvebla en | polaraj organikaj solvantoj | |||
| Acideco (pKa) | 2,86 | |||
| Merck Index |
| |||
| Ekflama temperaturo | 110 °C (230 ℉; 383 K) °C | |||
| Sekurecaj Indikoj | ||||
| Risko | R23/24/25 R36 | |||
| Sekureco | S36/37/39 S45 | |||
| Pridanĝeraj indikoj | ||||
| Danĝero
| ||||
| GHS etikedigo de kemiaĵoj | ||||
| GHS Damaĝo-piktogramo |
| |||
| GHS Signalvorto | Damaĝa substanco | |||
| GHS Deklaroj pri damaĝoj | H301+311+331, H314, H317, H400 | |||
| GHS Deklaroj pri antaŭgardoj | P273, P280, P284, P303+361+353, P305+351+338 | |||
Bromoacetata acido, acido de bromoacetato aŭ BrH2C-COOH estas kemia organika kombinaĵo, derivaĵo el acetata acido kie unu hidrogenatomo estas anstataŭata de bromo-atomo, senkolora likvaĵo uzata kiel peraĵo en kemiaj sintezoj kaj rilative forta alkiligagento. Bromoacetata acidoj kaj ĝiaj esteroj estas vaste uzataj por la manufakturo de aliaj kombinaĵoj kaj farmaciaĵoj.
Sintezo redakti
- Bromoacetata acido estas sintezebla per bromigo de la acetata acido:
- Aŭ per reakcio de kloroacetata acido kaj kalia bromido, pere de nukleofila substituado[1], ankaŭ konata kiel procezo de Hell[2]-Volhard[3]-Zelinsky[4]:
Proprecoj redakti
La unubromoacetata acido prezentiĝas kiel senkoloraj kristaloj kun akra odoro, kiu fandiĝas je 50 °C kaj facile dissolviĝas en akvo, etanolo, duetila etero kaj aliaj organikaj solvaĵoj. Ĝia akva solvaĵo estas forte acida, pli acida ol acetata acido (pKa 2,69 kontraŭ 4,76 de ĉi-lasta), pro tio ke la bromoacetata anjono estas stabiligita de la bromoatomo, kiu estas elektronegativa kaj do ĝi permesas delokigon de la negativa ŝarĝo de la molekulo.
Uzoj redakti
Bromoacetata acido uzatas kiel deirpunkto por sennombraj sintezoj, ekzemple de pesticidoj kaj medikamentoj. Ĝi uzatas senpere kiel konservanto de manĝaĵoj, tamen nuntempe ĉi-utiligo estas malpermesata en pluraj landoj.
Unubromoacetata acido estas forte alkiligagento kaj havas inhibo-efekton sur enzimoj posedantaj la grupon tiolon (-SH), alkoholon (-OH) aŭ aminon (-NH2) sur ĝia aktiva centro. Aliflanke, ĝi jam estis uzita por dolĉigi la francan vinon. En 1980, skandalo ekiĝis en Germanio kiam oni malkovris ĝian uzon kiel biero-konservanton.
La volatilaj esteroj de unubromoacetata acido uzatas kiel larmigan gason; ili estas iritaj por la okuloj kaj spirsistemo kaj povas esti danĝeraj. En pli altaj koncentriĝoj ili estas korodaj kaj povas kaŭzi vivodaŭran damaĝoj al okuloj.
Literaturo redakti
Halogenidaj derivaĵoj de acetata acido redakti
Referencoj redakti
- ↑ Nukleofila substituado estas kemia reakcio kie, iu nukleofilo, riĉa je elektronoj, estas anstataŭata per elektrofila grupo, malriĉa je elektronoj.
- ↑ Carl Magnus von Hell (1849-1926) estis germana kemiisto kaj profesoro en la Teknika Universitato de Stuttgart.
- ↑ [Jacob Volhard (1834–1910) estis germana kemiisto kiu prilaboris plurajn kemiajn sintezojn.
- ↑ Nikolay Zelinsky (1861-1953) estis rusa kemiisto kaj membro de la Rusa Akademio de Sciencoj.






