Kalia ditionito
Plata kemia strukturo de la
Tridimensia kemia strukturo de la
Alternativa(j) nomo(j)
Dutionito de kalio
Kalia salo de ditionita acido
Hidrosulfito de kalio* Kalia hidrosulfito
Hiposulfito de kalio* Kalia hiposulfito
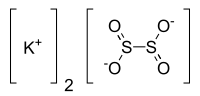
Kemia formulo K2 S2 O4
CAS-numero-kodo 14293-73-3
ChemSpider kodo 55625
PubChem-kodo 61726
Fizikaj proprecoj
Aspekto klarflava pulvoro
Molmaso 206313 g·mol−1
Denseco 2,5g cm−3
Bolpunkto 300 °C (malkomponiĝas)
Ekflama temperaturo 100 °C
Memsparka temperaturo 190 °C [1]
Solvebleco Akvo :50 g/L [2]
Mortiga dozo (LD50) 100 mg/kg (buŝe)
Sekurecaj Indikoj
Riskoj R7 R22 R31
Sekureco S7/8 S26 S28 S43
Pridanĝeraj indikoj
Danĝero
GHS Damaĝo Piktogramo
GHS Signalvorto Damaĝa substanco
GHS Deklaroj pri damaĝoj H251 , H302 , H411
GHS Deklaroj pri antaŭgardoj P235+410 , P264 , P270 , P273 , P280 , P301+312 , P330 , P391 , P407 , P410 , P420 , P501
Escepte kiam indikitaj, datumoj estas prezentataj laŭ iliaj normaj kondiĉoj pri temperaturo kaj premo25 °C kaj 100 kPa)
Kalia ditionito aŭ K2 S2 O4 estas neorganika salo de kalio , sulfuro kaj oksigeno , flavecaj kristaloj kun malforta sulfurodoro , stabila substanco en normalaj kondiĉoj kiu malkomponiĝas en varma akvo kaj acidaj solvaĵoj.
Kelkfoje ĉi-varmo sufiĉas por bruligi la ĉirkaŭantajn oksidivajn materialojn. Ĝi estas akvosolvebla , kaj sub longedaŭra ekspozicio al fajro aŭ apudeco al varmaj enhavaĵoj, ĉi-materialo povas subite rompiĝi. Ĝi same uzatas en tinkturoj kaj blankigo de ligna pulpo.
2
K
O
H
+
S
O
2
+
Z
n
→
0
o
C
K
2
S
2
O
4
+
Z
n
(
O
H
)
2
↓
{\displaystyle {\mathsf {2\;KOH+SO_{2}+Zn\ {\xrightarrow {0^{o}C}}\ K_{2}S_{2}O_{4}+Zn(OH)_{2}\downarrow }}}
2
S
O
2
+
2
K
H
g
→
10
o
C
K
2
S
2
O
4
{\displaystyle {\mathsf {2\;SO_{2}+2\;K_{Hg}\ {\xrightarrow {10^{o}C}}\ K_{2}S_{2}O_{4}}}}
4
K
H
S
O
3
→
0
o
C
,
e
−
2
K
2
S
2
O
4
+
O
2
↑
+
2
H
2
O
{\displaystyle {\mathsf {4\;KHSO_{3}\ {\xrightarrow {0^{o}C,e^{-}}}\ 2\;K_{2}S_{2}O_{4}+O_{2}\uparrow +2\;H_{2}O}}}
H
C
O
O
K
+
2
S
O
2
+
K
O
H
⟶
K
2
S
2
O
4
+
C
O
2
+
H
2
O
{\displaystyle \mathrm {HCOOK+2\;SO_{2}+KOH\longrightarrow K_{2}S_{2}O_{4}+CO_{2}+H_{2}O} }
K
B
H
4
+
8
S
O
2
+
8
K
O
H
⟶
{\displaystyle \mathrm {KBH_{4}+8\;SO_{2}+8\;KOH\longrightarrow } }
4
K
2
S
2
O
4
+
K
B
O
2
+
6
H
2
O
{\displaystyle \mathrm {4\;K_{2}S_{2}O_{4}+KBO_{2}+6\;H_{2}O} }
Z
n
+
2
S
O
2
⟶
Z
n
S
2
O
4
{\displaystyle \mathrm {Zn+2\;SO_{2}\longrightarrow ZnS_{2}O_{4}} }
Z
n
S
2
O
4
+
2
K
O
H
⟶
Z
n
(
O
H
)
2
+
K
2
S
2
O
4
{\displaystyle \mathrm {ZnS_{2}O_{4}+2\;KOH\longrightarrow Zn(OH)_{2}+K_{2}S_{2}O_{4}} }
Ĝi malkomponiĝas kiam hejtata:
2
K
2
S
2
O
4
→
52
o
C
K
2
S
O
3
S
+
K
2
S
2
O
5
{\displaystyle {\mathsf {2\;K_{2}S_{2}O_{4}\ {\xrightarrow {52^{o}C}}\ K_{2}SO_{3}S+K_{2}S_{2}O_{5}}}}
La kristala salo estiĝas per hejtado de etanola solvaĵo:
K
2
S
2
O
4
⋅
2
H
2
O
→
40
−
50
o
C
K
2
S
2
O
4
↓
+
2
H
2
O
{\displaystyle {\mathsf {K_{2}S_{2}O_{4}\cdot 2\;H_{2}O\ {\xrightarrow {40-50^{o}C}}\ K_{2}S_{2}O_{4}\downarrow +2\;H_{2}O}}}
Per hejtata akvo ĝi suferas disproporcion:
2
K
2
S
2
O
4
+
H
2
O
→
T
2
K
H
S
O
3
+
K
2
S
O
3
S
{\displaystyle {\mathsf {2\;K_{2}S_{2}O_{4}+H_{2}O\ {\xrightarrow {T}}\ 2\;KHSO_{3}+K_{2}SO_{3}S}}}
Ĝi malkomponiĝas en la ĉeesto de acido, malvarme:
K
2
S
2
O
4
+
2
H
C
l
→
0
o
C
2
K
C
l
+
H
2
S
2
O
4
{\displaystyle {\mathsf {K_{2}S_{2}O_{4}+2HCl\ {\xrightarrow {0^{o}C}}\ 2\;KCl+H_{2}S_{2}O_{4}}}}
2
K
2
S
2
O
4
+
2
H
C
l
+
H
2
O
→
20
o
C
3
K
H
S
O
3
+
S
↓
+
K
C
l
{\displaystyle {\mathsf {2\;K_{2}S_{2}O_{4}+2HCl+H_{2}O\ {\xrightarrow {20^{o}C}}\ 3\;KHSO_{3}+S\downarrow +KCl}}}
Ĝi spontanee oksidiĝas per la atmosfera oksigeno:
2
K
2
S
2
O
4
+
O
2
→
2
K
2
S
2
O
5
{\displaystyle {\mathsf {2\;K_{2}S_{2}O_{4}+O_{2}\ {\xrightarrow {}}\ 2\;K_{2}S_{2}O_{5}}}}
2
K
2
S
2
O
4
+
O
2
+
2
H
2
O
→
4
K
H
S
O
3
{\displaystyle {\mathsf {2\;K_{2}S_{2}O_{4}+O_{2}+2\;H_{2}O\ {\xrightarrow {}}\ 4\;KHSO_{3}}}}
Ĝi restarigas la metalojn malpli aktivajn:
K
2
S
2
O
4
+
2
A
g
N
O
3
→
2
A
g
↓
+
2
S
O
2
↑
+
2
K
N
O
3
{\displaystyle {\mathsf {K_{2}S_{2}O_{4}+2\;AgNO_{3}\ {\xrightarrow {}}\ 2\;Ag\downarrow +2SO_{2}\uparrow +2\;KNO_{3}}}}