Kalia oksido
kemia kombinaĵo
| Kalia oksido | |||
| Plata kemia strukturo de la Kalia oksido | |||
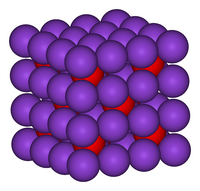 | |||
| Tridimensia kemia strukturo de la Kalia oksido | |||
| Alternativa(j) nomo(j) | |||
| |||
| Kemia formulo | |||
| CAS-numero-kodo | 12136-45-7 | ||
| ChemSpider kodo | 23354117 | ||
| PubChem-kodo | 9989219 | ||
| Fizikaj proprecoj | |||
| Aspekto | palflava soldiaĵo | ||
| Molmaso | 94.2034 g·mol−1 | ||
| Denseco | 2.35g cm−3 | ||
| Fandpunkto | 350 (malkomponiĝas) °C[1] | ||
| Solvebleco | Akvo:reakcias | ||
| Sekurecaj Indikoj | |||
| Riskoj | R20/21/22 R34 [[Listo
da R-Deklaroj#R36/37/38|R36/37/38]] | ||
| Sekureco | S20/21 S22 [[Listo de
S-Deklaroj#S24|S24]] S25 S36/37 [[Listo de S- Deklaroj#S45|S45]] S53 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS Damaĝo Piktogramo |
| ||
| GHS Signalvorto | Damaĝa substanco | ||
| GHS Deklaroj pri damaĝoj | H314 | ||
| GHS Deklaroj pri antaŭgardoj | P101, P102, P260, P264, P280, P303+361+353, P305+351+338, P405, P501 | ||
(25 °C kaj 100 kPa) | |||
Kalia oksido aŭ K2O estas jona komponaĵo de kalio kaj oksigeno, palflava solidaĵo, rare trovata en naturo pro ĝia alta reakciemo. Kelkaj komercaj materialoj, tiaj kiaj sterkoj kaj cementoj, estas taksataj konsiderante la procentan komponadon kiu egalvaloras al la kemia komponaĵo. Kalia oksido ofte uzatas en formulaĵoj de sterkoj, cementoj[2] kaj por vitrofabrikado.[3] Kalia oksido brulas per lilkoloraj flamoj.[4]
Sintezoj
redaktiSintezo 1
redakti- Ekde la metalo kun oksigeno:
|
|
Sintezo 2
redakti- Eksceso de kalio estigas kalian oksidon kaj kalian peroksidon:
|
|
Sintezo 3
redakti- Traktado de kalia nitrato kaj metala kalio:
|
|
Sintezo 4
redakti- Pura kalia oksido estiĝas per agado de kalia nitrido kaj kalia nitrato:
|
|
Sintezo 5
redakti- kalia hidroksido reakcias kun metala kalio por estigi kalian oksidon kaj hidrogenon:
|
|
Sintezo 6
redakti- Kalia peroksido reduktiĝas al kalia oksido en la ĉeesto de kalio:[5]
|
|
Sintezo 7
redakti- Kalia karbonato estigas kalian oksidon per hejtado:[6]
|
|
Sintezo 8
redakti- Tre facila maniero por prepari kalian oksidon estas per varmigo de kalia nitrato kun metala kalio:
|
|
Reakcioj
redaktiReakcio 1
redakti- kalia oksido interagas kun akvo por estigi kalian hidroksidon:
|
|
Reakcio 2
redakti- Ĝi reakcias kun karbona duoksido por estigi kalian karbonaton:
|
|
Reakcio 3
redakti- kalia oksido reakcias kun klorida acido por estigi kalian kloridon kaj akvon:
|
|
Reakcio 4
redakti- kalia oksido eksplode reakcias kun acidoj estigante solvaĵojn de la respektivaj saloj:[7]
|
|
Literaturo
redaktiReferencoj
redakti- ↑ Centroj por Kontrolo kaj Preventado de Malsanoj (CDC, Centers for Disease Control and Prevention)
- ↑ Symposium on Flame Photometry
- ↑ Chinese Glazes: Their Origins, Chemistry, and Recreation
- ↑ O-level Science-Chemistry Effective Guide
- ↑ Peroxides, Superoxides, and Ozonides of Alkali and Alkaline Earth Metals, I. I. Volnov
- ↑ Chemistry - Science and Technology III[rompita ligilo]
- ↑ Advanced Chemistry, Michael Clugston, Rosalind Flemming


