Kalia karbonato
| Kalia karbonato | ||
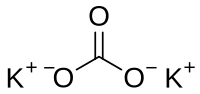 | ||
| Plata kemia strukturo de la Kalia karbonato | ||
 | ||
| Tridimensia kemia strukturo de la Kalia karbonato | ||
 | ||
| Blankaj kristaloj de kalia karbonato. | ||
| Alternativa(j) nomo(j) | ||
| ||
| Kemia formulo | ||
| CAS-numero-kodo | 584-08-7 | |
| ChemSpider kodo | 10949 | |
| PubChem-kodo | 11430 | |
| Merck Index | 15,7740 | |
| Fizikaj proprecoj | ||
| Aspekto | blanka higroskopa solidaĵo | |
| Molmaso | 138.205 g·mol−1 | |
| Denseco | 2.43g cm−3 | |
| Fandpunkto | 891 °C | |
| Acideco (pKa) | 10.25 | |
| Solvebleco | Akvo:1120 g/L | |
| Mortiga dozo (LD50) | 1870 mg/kg (buŝe) | |
| Sekurecaj Indikoj | ||
| Riskoj | R36/37/38 | |
| Sekureco | S22 S26 | |
| Pridanĝeraj indikoj | ||
| Danĝero
| ||
| GHS etikedigo de kemiaĵoj | ||
| GHS Damaĝo-piktogramo |
| |
| GHS Signalvorto | Averto | |
| GHS Deklaroj pri damaĝoj | H302, H315, H319, H335[1] | |
| GHS Deklaroj pri antaŭgardoj | P261, P264, P270, P271, P280, P301+312, P302+352, P304+340, P305+351+338, P312, P321, P330, P332+313, P337+313, P362, P403+233, P405, P501 | |
(25 °C kaj 100 kPa) | ||
Kalia karbonato estas blanka salo, solvebla en akvo, rezultanta el interagado de la kalia hidroksido kaj karbonata acido. Ĝi estas nature trovata kiel erco sed en la pasinteco ĝi estis produktita per cindrigo de lignoj kaj organikaj materialoj.
Ekde la mezo de la 19-a jarcento, la salrestaĵoj de la ŝton-sala industrio kaj saldeponaĵoj estas la krudmaterialoj por produktado de kalia karbonato. Nuntempe, la plej grava industria procezo estas la karbonigo de la kalia hidroksido elektrolite produktita.
Duono de la kalia hidroksido estas saturita per karbona duoksido. La fina solvaĵo parte vaporiĝas kaj la hidrato de kalia karbonato precipitiĝas permesante la separadon. Post sekigo, la produkto povas komerciĝi kiel hidratigita materialo aŭ kalcinita en rotacia forno kun temperaturo inter 250 °C kaj 350 °C.
Kalia karbonato uzatas en la fabrikado de sapoj, vitraĵoj, kiel sekigagento, moliganto de akvo kaj bufrigagento en la produktado de vino kaj medo
Sintezoj
redaktiSintezo 1
redakti- Preparado per traktado de karbonata acido kaj kalia hidroksido:
Sintezo 2
redakti- Preparado per traktado de karbona duoksido kaj natria hidroksido:
Sintezo 3
redakti- Preparado per traktado de karbonata acido kaj kalia formiato:
Sintezo 4
redakti- Preparado per traktado de kalia klorido kaj etila karbonato:
Sintezo 5
redakti- Preparado per interagado de metila karbonato kaj kalia formiato:
Sintezo 6
redakti- Preparado per acida interŝanĝo de karbonata acido kaj kalia acetato:
Sintezo 7
redakti- Preparado per duobla interŝanĝo de izopropila karbonato kaj kalia hidroksido:
Reakcioj
redaktiReakcio 1
redakti- Hidrolizo de la kalia karbonato
Reakcio 2
redakti- Reakcio kun sulfata acido:
Reakcio 3
redakti- Preparado de kalia butanato per acida interŝanĝo inter kalia karbonato kaj buterata acido:
Reakcio 4
redakti- Preparado de metila karbonato per alkohola interŝanĝo de kalia karbonato kaj metanolo en acida medio:
Reakcio 5
redakti- Senkarboksiligo de la kalia karbonato:
Reakcio 6
redakti- Preparado de kalia sulfito per interŝanĝo de kalia karbonato kaj sulfita acido:
Reakcio 7
redakti- Reakcio kun klorida acido:
Reakcio 8
redakti- Preparado de kalia nitrato per interŝanĝo de kalia karbonato kaj nitrata acido:
Literaturo
redakti- Chemical Book
- Breckland Scientific Arkivigite je 2017-08-22 per la retarkivo Wayback Machine
- West Liberty University
- Chemistry in Context, Graham Hill, John Holman
- A Manual for the Chemical Analysis of Metals
- Encyclopedia of Food and Color Additives, Volume 3, George A. Burdock
- Industrial Inorganic Chemistry, Karl Heinz Büchel, Hans-Heinrich Moretto, Dietmar Werner

