Amonia magnezia fosfato
| Amonia magnezia fosfato | ||
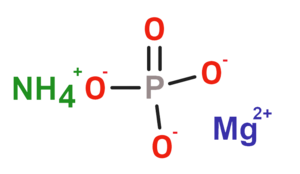
| ||
| 2D Kemia strukturo de la Amonia magnezia fosfato | ||

| ||
| 3D Kemia strukturo de la Amonia magnezia fosfato | ||

| ||
| Struvito: erco de amonia magnezia fosfato | ||
| Alternativa(j) nomo(j) | ||
| Duobla salo de amonia kaj magnezia fosfata acido | ||
| Kemia formulo | ||
| CAS-numero-kodo | 7785-21-9 | |
| ChemSpider kodo | 155566 | |
| Fizikaj proprecoj | ||
| Aspekto | Blankaj aŭ flavaj kristaloj | |
| Molmaso |
| |
| Smiles | [NH4+].[O-]P(=O)([O-])[O-].[Mg+2] | |
| Denseco | 1,71 g/cm3 | |
| Refrakta indico | 1 495 | |
| Solvebleco | Akvo:Malmulte solvebla | |
| GHS etikedigo de kemiaĵoj | ||
| GHS Damaĝo-piktogramo |
| |
| GHS Signalvorto | Damaĝa substanco | |
| GHS Deklaroj pri damaĝoj | H314 | |
| GHS Deklaroj pri antaŭgardoj | P280, P305+351+338, P310 | |
(25 °C kaj 100 kPa) | ||
Amonia magnezia fosfato, magnezia fosfato de amonio aŭ NH4MgPO4 estas neorganika duobla salo de fosfata acido, amoniako kaj magnezio, trovata en naturo sub la formo heksahidrata, kaj konata kiel la mineralo "struvito", omaĝe al la germana kemiisto Heinrich Christian Gottfried von Struve (1772–1851).[1] Ĝi kristaliĝas kiel ortoromba strukturo, kaj estas blanka aŭ bruneca-flavkolora piramidaj kristaloj.
Renaj ŝtonoj el amonia magnezia fosfato
redaktiLa struvito precipitiĝas en alkala urino estigante la kalkulusojn aŭ renŝtonojn.[2] Tiuj ŝtonoj estas la plej ordinaraj mineraloj trovataj en la urina sistemo de hundoj, katoj kaj homoj. La struvitaj ŝtonoj estas potencigitaj de bakteriaj infekcioj kiuj hidrolizas la ureon en amonion kaj altigas la pH-on al neŭtralaj kaj alkalaj valoroj. Urea-rompantaj organismoj inkluzivas la proteobakterion, pseŭdomono-bakteriojn, pneŭmonita klebsiella, stafilokokojn kaj mikoplasmojn[3].
Literaturo
redakti- The Free Dictionary
- Science Direct
- Urology Stone Arkivigite je 2015-01-10 per la retarkivo Wayback Machine
- American Family Physician
- Sigma Aldrich
- Santa Cruz Biotechnology Arkivigite je 2016-06-18 per la retarkivo Wayback Machine
- Chemical Book
- New Zealand Journal of Agricultural Research Dec 1976[rompita ligilo]
Referencoj
redakti- ↑ Urinary Stone Disease: The Practical Guide to Medical and Surgical Management, Marshall L. Stoller, Maxwell V. Meng
- ↑ Phosphoric Acids—Advances in Research and Application: 2013 Edition ...
- ↑ Mikoplasmoj tre etaj eŭbakterioj kiuj estigas iajn pneŭmonitojn.

