Nitrogena tribromido
kemia kombinaĵo
| Nitrogena tribromido | |||||
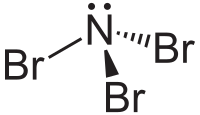 | |||||
| Plata kemia strukturo de la Nitrogena tribromido | |||||
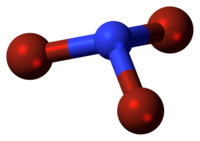 | |||||
| Tridimensia kemia strukturo de la Nitrogena tribromido | |||||
| Alternativa(j) nomo(j) | |||||
| |||||
| Kemia formulo | |||||
| CAS-numero-kodo | 15162-90-0 | ||||
| ChemSpider kodo | 20480821 | ||||
| PubChem-kodo | 3082084 | ||||
| Fizikaj proprecoj | |||||
| Aspekto | forte violkolora-ruĝa oleeca likvaĵo kun malagrable penetranta odoro kaj eksplodaj proprecoj | ||||
| Molmaso | 253,719 g·mol-1 | ||||
| Fandpunkto | -100°C | ||||
| Refrakta indico | 1,695 | ||||
| Solvebleco | Akvo:reakcias | ||||
| Sekurecaj Indikoj | |||||
| Riskoj | R14 R26/28 R35 R48/20 | ||||
| Sekureco | S7/8 S26 S36/37/39 S45 | ||||
| Pridanĝeraj indikoj | |||||
| Danĝero
| |||||
| GHS Damaĝo Piktogramo |
| ||||
| GHS Signalvorto | Damaĝa substanco | ||||
| GHS Deklaroj pri damaĝoj | H270, H280, H332, H373 | ||||
| GHS Deklaroj pri antaŭgardoj | P220, P244, P260, P261, P271, P304+312, P304+340, P314, P370+376, P403, P410+403, P501 | ||||
(25 °C kaj 100 kPa) | |||||
Nitrogena tribromido aŭ NBr3 estas neorganika nitrogena kombinaĵo de bromo, forte ruĝa oleeca likvaĵo[1] kun malagrable penetranta odoro kaj eksplodaj proprecoj, kredeble ekzistanta nur en malhelaj ujoj sub malaltegaj temperaturoj (-100°C), solvebla en duetila etero, dukloro-metano kaj pentano. Tribromo-amino estas alte endoterma substanco pro tio ĝi facile eksplodas.
Kvankam nitrogeno estis unue sintezita en 1812 de la franca kemiisto Bernard Courtois (1777-1838), tribromo-amino estis nur izolita en 1975. La plej tradicia preparado-formo estas per traktado de bromo sur amoniako en fermita ujo sub malaltegaj temperaturoj (-70°C aŭ malpli).
Sintezoj
redaktiSintezo 1
redakti- Preparado per traktado de nitrogena triklorido kaj kalia bromido:
Sintezo 2
redakti- Preparado per interagado de amonia bromido, natria klorito kaj fera (III) bromido:
Sintezo 3
redakti- Preparado per interagado de amonia bromido kaj bromo:
Sintezo 4
redakti- Preparado per traktado de amoniako kaj bromida acido:
Reakcioj
redaktiReakcio 1
redakti- Malkomponado de nitrogena tribromido:
Reakcio 2
redakti- Hidrolizo de nitrogena tribromido:
Reakcio 3
redakti- Reakcio de nitrogena tribromido kaj natria bromito en akva solvaĵo:[2]
Reakcio 4
redakti- Reakcio de nitrogena tribromido kaj amoniako en ĉeesto de dukloro-metano:
Reakcio 5
redakti- Bromigo de piridino. Dum tiu procezo, estiĝas bromohidrazino kiu siavice malkomponiĝas en nitrogeno kaj bromo:
Reakcio 6
redakti- Preparado de ruĝbruna solidaĵo, konata kiel nitrogena jodido dubromido:
Reakcio 7
redakti- Reakcio de nitrogena tribromido kaj natria hipobromito:
Reakcio 8
redakti- Preparado de dunitrogena trioksido:[3]








