Molekulo
| Ĉi tiu artikolo temas pri ero de materio. Por esperantlingva libro rigardu la paĝon Molekuloj (libro). |
Molekulo estas kunmetaĵo, elektre neŭtra, de almenaŭ du atomoj, kiuj povas libere ekzisti. Ĝi estas la plej malgranda ero de kemia korpo konservanta ankoraŭ la ecojn de la tuto kaj nedisigebla per fizikaj procedoj.
Per kemiaj reakcioj, la molekuloj povas esti dividataj en pli malgrandajn eretojn, pluraj molekuloj povas kuniĝi en pli granda molekulo, aŭ du (aŭ pluraj) molekuloj povas interŝanĝi atomojn aŭ atomgrupojn (tiel nomataj radikaloj).
Ekzemploj de ordinara molekulo estas O2, (du atomoj de oksigeno), kaj CO2, karbona dioksido, unu atomo de karbono kaj du de oksigeno.
Priskribo redakti
Molekulo estas la plej malgranda nedividebla parto de pura kemia substanco kiu havas sian unikan aron de kemiaj proprecoj, tio estas, ties potencialo por elteni ian aron de kemiaj reagoj kun aliaj substancoj. Tamen, tiu difino bone funkcias nur por substancoj kiuj estas komponitaj el molekuloj, kio ne okazas en multaj substancoj (vidu sube). Molekuloj estas tipe aro de atomoj kunligitaj per kovalentaj ligoj, tiel ke la strukturo estas elektre neŭtrala kaj ĉiuj valentaj elektronoj estas parigitaj kun aliaj elektronoj ĉu per ligoj ĉu en izolaj paroj.
Tiel, molekuloj ekzistas kiel elektre neŭtralaj unuoj, male al jonoj. Kiam tiu regulo estas rompita, havigante al la "molekulo" ŝarĝon, la rezulto estas foje nomita molekula jono aŭ pluratoma jono. Tamen, la diskreta kaj separata naturo de la molekula koncepto kutime postulas, ke molekulaj jonoj aperu nur en bone-separata formo, kiel direktita radio en vakuo en mas-spektromezurilo. Ŝarĝitaj pluratomaj kolektoj ekzistantaj en solidoj (por ekzemplo, komunaj sulfataj aŭ nitrataj jonoj) estas ĝenerale nekonsiderataj "molekuloj" en kemio. Kelkaj molekuloj enhavas unu aŭ pliajn neparigitajn elektronojn, kreante radikalojn. Plej radikaloj estas kompare reagemaj, sed kelkaj, kiel la Nitrogena monooksido (NO) povas esti stabilaj.
La "inertaj" aŭ noblagasaj elementoj (heliumo, neono, argono, kriptono, ksenono kaj radono) estas komponitaj el izolaj atomoj kiel plej malgranda diskreta unuo, sed la aliaj izolaj kemiaj elementoj konsistas el ĉu molekuloj aŭ ĉu retoj de atomoj ligitaj unuj al aliaj iel. Identigeblaj molekuloj komponas familiarajn substancojn kiel akvo, aero, kaj multajn organikajn komponaĵojn kiel alkoholo, sukero, benzino, kaj la variaj kuraciloj.
Tamen, ne ĉiuj substancoj aŭ kemiaj komponaĵoj konsistas el diskretaj molekuloj, kaj ja plej el la solidaj substancoj kiuj dormas la solidan kruston, mantelon kaj kernon de la Tero estas kemiaj komponaĵoj sen molekuloj. Tiuj aliaj tipoj de substancoj, kiel la jonaj komponaĵoj kaj la ĉensolidoj, estas organizitaj tiel ke mankas la ekzisto de identigeblaj molekuloj per se. Anstataŭe, tiuj substancoj estas studataj kiel unuecaj formuloj aŭ unuecaj ĉeloj kiel la plej malgranda ripetata strukturo ene de la substanco. Ekzemploj de tiaj substancoj estas mineralaj saloj (kiel la tablosalo), solidoj kiel karbono kaj diamantoj, metaloj, kaj familiaraj silico kaj silikatmineraloj kiel kvarco kaj granito.
Unu el la ĉefaj karakteroj de molekulo estas ties geometrio ofte nomata ties strukturo. Kvankam la strukturo de diatomaj, triatomaj aŭ kvar-atomaj molekuloj povas esti triviala (linia, angula piramida ktp.), la strukturo de pluratomaj molekuloj, kiuj estas konstituitaj de pli ol ses atomoj (de kelkaj elementoj) povas esti ŝlosila pro sia kemia naturo.
Struktura formulo redakti
La struktura formulo estas speco de ĥemia formulo. Ĝi indikas la strukturon (spacan aranĝon), laŭ kiu la atomoj de diversaj elementoj konsistigas unu molekulon de kemia kombinaĵo.
Struktura formulo notas la elementojn per iliaj simbolaj literoj. Por noti la strukturon ekzistas diversaj metodoj:
- Oni ligas la atomojn, kiuj estas kemie ligitaj, per strekoj, iel projekciante la tri-dimensian strukturon de la molekulo al du-dimensia desegnaĵo.
- En organika kemio estas kutimo ne marki la atomojn de karbono kaj hidrogeno; ĉiu sen-litera fino de streko estas implicite karbona atomo, kaj ĉiu nesaturita ligo de karbona atomo estas implicite hidrogena atomo. Tia formulo nomiĝas skeleta formulo.
- Se kombinaĵo konsistas el atom-grupoj, kies interna strukturo estas klara, oni notas tiujn grupojn per ilia resuma formulo. Ekzemple metila grupo estas skribata CH3, ankaŭ en struktura formulo. Per tio ofte eblas noti strukturan formulon unudimensie, do en teksta linio, ekzemple propanon kiel CH3CH2CH3. Eblas uzi rondajn krampojn por grupigi atomojn. Tiaj formuloj nomiĝas duon-strukturaj formuloj.
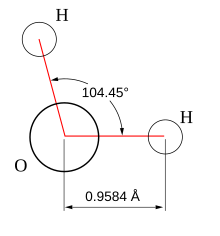
- Se simpla kombinaĵo havas nur unu izomeron, sufiĉas indiki la resuman formulon. Ekzemple estas klare, ke la strukturo de akvo (H2O) povas esti nur molekulo H-O-H.
Movoj redakti
La Brown-a movado, aŭ pli esperante braŭna movado, matematike priskribas la hazardajn movojn de "granda" partiklo, enmetita en likvon, kaj kiu kolizias kontraŭ aliaj "malgrandaj" partikloj (tio estas la molekuloj en la likvo). La rezulto estas malregula movado de la granda partiklo, kiun la botanikisto Robert Brown unufoje priskribis en 1827. Li observis movojn de partikloj en poleneroj de Clarkia pulchella (speco de natura floro en Nord-Ameriko), kaj poste de aliaj diversaj plantoj.
Molekula mekaniko redakti
Molekula mekaniko estas metodaro kiun oni kelkfoje kvalifikas kiel branĉo kaj de teoria kemio kaj de komputika kemio. Ĝi, per uzo de la klasika mekaniko klopodas modelumi molekulajn sistemojn. La potencialan energion de ĉiu ajn sistemo oni kalkulas per fortokampoj. Molekula mekaniko povas esti uzata por pristudi kaj malgrandajn molekulojn kaj grandegajn biologiajn sistemojn.
Ĉiu molekulmekanika metodo havas la jenajn ecojn:
- Ĉiu atomo estas modelumata kvazaŭ ĝi estu simpla partiklo.
- Al ĉiu partiklo oni asignas radiuson (ofte la Radiuso de van der Waals) kaj konstantan netan ŝargon (ĝenerale atingataj el kvantumaj kalkuloj kaj/aŭ eksperimentoj).
- Kemiajn ligojn oni vidas kiel "risortaro" kies ekvilibra distanco egalas al la eksperimenta aŭ kalkulita ligolongo.
Teoriaj aspektoj redakti
La studo de molekuloj pere de la molekula fiziko kaj la teoria kemio estas bazita ĉefe sur kvantumaj mekanikoj kaj temas esence pri la kompreno de la kemia ligo. La plej simpla el la molekuloj estas la hidrogenmolekula jono, H2+, kaj la plej simpla el ĉiuj kemiaj ligoj estas la unu-elektrona ligo. H2+ estas kombinaĵo el du pozitive ŝarĝitaj protonoj kaj unu negative ŝarĝita elektrono, kio signifas, ke la Ekvacio de Schrödinger por la sistemo povas esti solvita pli facile pro la manko de elektron–elektrona opozicio. Per la disvolvigo de rapidaj ciferecaj komputiloj, proksimumaj solvoj por pli komplikaj molekuloj ebliĝis kaj ili estas unu el la ĉefaj aspektoj de komputika kemio.
Klopodante difini rigore ĉu aranĝo de atomoj estas sufiĉe stabila por esti konsiderata molekulo, la IUTAK (Internacia Unio de Teoria kaj Aplika Kemio) sugestas, ke ĝi "devas korespondi al depresio de la surfaco de la potenciala energio kiu estas sufiĉe profunda por limigi almenaŭ unu vibrostaton".[1] Tiu difino ne dependas el la naturo de la interagado inter la atomoj, sed nur je la forto de la interagado. Fakte, ĝi inkludas malfortajn ligospecojn kiuj tradicie ne estas konsiderataj molekuloj, kiel la dimero de heliumo, He2, kiu havas unu vibran ligostaton[2] kaj estas izole ligita, kio estas ŝajne observebla je tre malaltaj temperaturoj.
Ĉu jes aŭ ne aranĝo de atomoj estas sufiĉe stabila por esti konsiderata molekulo estas esence funkcia difino. Filozofie, molekulo ne estas fundamenta ento (kontraste, por ekzemplo, al elementa partiklo); anstataŭe, la koncepto de molekulo estas la kemia maniero fari utilan aserton pri la fortoj de atom-skalaj interagadoj en la mondo kiun oni observas.
Bildaro redakti
Vidu ankaŭ redakti
Notoj redakti
- ↑ IUPAC, Compendium of Chemical Terminology, 2a eld. (the "Gold Book") (1997). reta korektita versio: (2006–) "Molecule". doi:10.1351/goldbook.M04002
- ↑ Anderson JB (Majo 2004). “Comment on "An exact quantum Monte Carlo calculation of the helium-helium intermolecular potential" [J. Chem. Phys. 115, 4546 (2001)]”, J Chem Phys 120 (20), p. 9886–7. doi:10.1063/1.1704638.
Bibliografio redakti
- Gustafson, S. J. & I. M. Sigal (2011): Mathematical Concepts of Quantum Mechanics, Springer-Verlag, ISBN 978-3-642-21866-8.