Alila klorido
| Alila klorido | |||||||
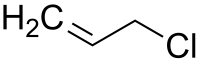 | |||||||
| Plata kemia strukturo de la Alila klorido | |||||||
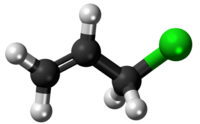 | |||||||
| Tridimensia kemia strukturo de la Alila klorido | |||||||
| Alternativa(j) nomo(j) | |||||||
| |||||||
| Kemia formulo | |||||||
| CAS-numero-kodo | 107-05-1 | ||||||
| ChemSpider kodo | 13836674 | ||||||
| PubChem-kodo | 7850 | ||||||
| Merck Index | 15,280 | ||||||
| Fizikaj proprecoj | |||||||
| Aspekto | senkolora, brulema, toksa likvaĵo kun tranĉa malagrabla odoro | ||||||
| Molmaso | 76,523 g·mol-1 | ||||||
| Denseco | 0,938g cm−3[1] | ||||||
| Fandpunkto | −134,5 °C | ||||||
| Bolpunkto | 44 °C | ||||||
| Refrakta indico | 1,4154 | ||||||
| Ekflama temperaturo | −31 °C | ||||||
| Memsparka temperaturo | 390 °C (fermita ujo) | ||||||
| Solvebleco | Akvo:3,6 g/L | ||||||
| Mortiga dozo (LD50) | 700 mg/kg (buŝe) | ||||||
| Sekurecaj Indikoj | |||||||
| Riskoj | R11 R20/21/22 R36/37/38 R40 R40 R48/20 R68 R50 | ||||||
| Sekureco | S2 S16 S25 S26 S36/37 S46 S61 | ||||||
| Pridanĝeraj indikoj | |||||||
| Danĝero
| |||||||
| GHS Damaĝo Piktogramo |
| ||||||
| GHS Signalvorto | Damaĝa substanco | ||||||
| GHS Deklaroj pri damaĝoj | H225, H301, H301, H302, H311, H312, H315, H318, H319, H331, H332, H335, H341, H351 | ||||||
| GHS Deklaroj pri antaŭgardoj | P201, P202, P210, P233, P240, P241, P242, P243, P260, P261, P264, P270, P271, P273, P280, P281, P301+310, P301+312, P302+352, P303+361+353, P304+312, P304+340, P305+351+338, P308+313, P310, P311, P314, P321, P330, P332+313[2] | ||||||
(25 °C kaj 100 kPa) | |||||||
Alila klorido aŭ C3H5Cl estas organika kombinaĵo de kloro kaj alila grupo (H2C=CH-CH2-), senkolora, brulema, toksa likvaĵo kun tranĉa kaj malagrabla odoro, uzata kiel kemia reakciaĵo en analizaj sintezoj. Ĝi estas uzata en la produktado de la epiklorohidrino, kiu estas uzata en la fabrikado de plastaĵoj. Ĝi estas alkiligagento, tre taŭga sed danĝera por manipulado.
Klorido de alilo estas malpli densa ol akvo kaj nesolvebla en akvo, do ĝi flosas sur la akvo. Ĝiaj vaporoj estas irital al haŭto, okuloj kaj mukozaj membranoj. Ĝiaj vaporoj estas pli densaj ol aero. Ĝi eksplode kaj ekzoterme reakcias kun acidoj de Lewis (aluminia klorido, bora trifluorido, sulfata acido, ktp) aŭ metaloj (aluminio, magnezia, zinko aŭ galvanizita metalo).
Ĝi estas neakordigebla kun acidoj (nitrata acido, klorosulfonata acido), kun fortaj bazoj (natria hidroksido, kalia hidroksido), kun aziridinoj kaj etilenoduamino. Provoj je benzeno- aŭ tolueno- alkiligoj uzante alilan kloridon en ĉeesto de etilaluminiaj kloridoj rezultas en eksplodojn. Ĝi estas alte brulema kaj neakordigebla kun fortaj oksidigagentoj, acidoj, aminoj, peroksidoj, kloridoj de fero kaj aluminio, aromataj hidrokarbonidoj, ktp.
Alila klorido estis unue produktita en 1857 de la franca kemiisto Auguste Cahours (1813-1891) kaj la germana kemiisto August von Hofmann (1818-1892) reakciigante alilan alkoholon kun PCl3. Modernaj metodoj je preparado preterlasas ĉi-procedon, anstataŭante la relative altkostan fosforan trikloridon per klorida acido kaj katalizilo tia kia la kupra (I) klorido.
Sintezoj
redaktiSintezo 1
redaktiSintezo 2
redakti- Preparado per traktado de alilamino kaj kloro:
Sintezo 3
redakti- Preparado per interagado de alila bromido kaj klorida acido:
Sintezo 4
redakti- Preparado per interagado de alila alkoholo kaj fosfora triklorido:
Sintezo 5
redakti- Preparado per interagado de alila alkoholo kaj nitrogena triklorido:
Sintezo 6
redakti- Preparado per reakcio inter alila alkoholo kaj nitrozila klorido:
Reakcioj
redaktiReakcio 1
redakti- Preparado de epiklorohidrino:
Reakcio 2
redakti- Preparado de alila alkoholo:
Reakcio 3
redakti- Reakcio kun magnezia klorido:
Reakcio 4
redakti- Preparado de alila izotiocianato:
Reakcio 5
redakti- Preparado de alilamino:
Reakcio 6
redakti- Preparado de alila cianido:
Reakcio 7
redakti- Preparado de 1,5-heksadueno:
Reakcio 8
redakti- Preparado de fenilpropeno:
Reakcio 9
redakti- Preparado de alila cianido:









