Naringenino
kemia kombinaĵo
| Naringenino | |||
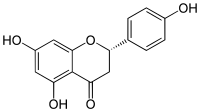 | |||
| Plata kemia strukturo de la Naringenino | |||
 | |||
| Tridimensia kemia strukturo de la Naringenino | |||
 | |||
| Naringenino estas antiinflamaĵo trovata en la ruĝa pomelo. | |||
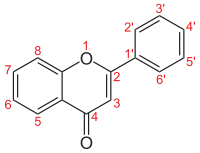 | |||
| Numerigo de la karbonaj strukturoj de la flavonoj. | |||
| Alternativa(j) nomo(j) | |||
| |||
| Kemia formulo | |||
| CAS-numero-kodo | 480-41-1 | ||
| ChemSpider kodo | 388383 | ||
| PubChem-kodo | 439246 | ||
| Fizikaj proprecoj | |||
| Aspekto | senkoloraj aŭ blankaj kristaloj | ||
| Molmaso | 272,25 g·mol−1 | ||
| Denseco | 1,2066g cm−3 | ||
| Fandpunkto | 247 °C−250 °C[1] | ||
| Bolpunkto | 577,5 °C[2] | ||
| Refrakta indico | 1 693 | ||
| Ekflama temperaturo | 224,7 °C | ||
| Acideco (pKa) | 7,52 | ||
| Solvebleco | Akvo:Nesolvebla | ||
| Sekurecaj Indikoj | |||
| Riskoj | R22 R36/37/38 | ||
| Sekureco | S26 S36 S37/37 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS Damaĝo Piktogramo |
| ||
| GHS Signalvorto | Averto | ||
| GHS Deklaroj pri damaĝoj | H315, H319 | ||
| GHS Deklaroj pri antaŭgardoj | P264, P280, P302+352, P305+351+338, P321, P332+313, P337+313, P362[3] | ||
(25 °C kaj 100 kPa) | |||
Naringenino, (3',5,7-trihidrokso-flavono) aŭ C15H12O5 estas natura kemia kunmetaĵo, senkolora aŭ blanka senodora solidaĵo, derivaĵo el la familio de la flavonoidoj, ordinare trovata en pomeloj, oranĝoj, citronoj kaj tanĝerinoj. Ĝi estas natura substanco kun antibakteriaj, antifungaj, antivirusaj, antiinflamaj, antioksidigaj kaj antikanceraj proprecoj. Naringenino estas uzata en la traktado de la Malsano de Alzheimer[4] kaj en la Parkinsona malsano. Ĝi estas nesolvebla en akvo sed solvebla en etanolo. En leŭkemiaj ĉeloj, naringenino induktas al apoptozo kaj inhibas la agadon de la hepatito C.
Sintezoj redakti
Sintezo 1 redakti
- Preparado ekde la apigenino per reduktado de la 2-a karbono de la kromenonila ringo:
Sintezo 2 redakti
- Preparado ekde la genisteino per ŝanĝo de la fenila grupo en la 3-a pozicio de la kromenonila ringo al la 2-a pozicio de la kromenonila ringo:
Sintezo 3 redakti
- Preparado ekde la luteolino per reduktado de la karbono en la 2-a pozicio de la kromenonila ringo kaj forigo de la hidroksila grupo en la 5-a pozicio de la fenila grupo:
Sintezo 4 redakti
- Preparado ekde la "prunino" per hidrolizo:
Sintezo 5 redakti
- Preparado ekde la akacetino per anstataŭado de la metoksila grupo je hidroksila grupo en la 4-a pozicio de la fenila grupo kaj reduktado de la karbono en la 2-a pozicio de la kromenonila ringo:
Sintezo 6 redakti
- Preparado ekde la kverketino per forigo de du hidroksilaj grupoj, unu en la 3-a pozicio de la kromenonila ringo kaj alia en la 5-a pozicio de la fenila ringo:
Sintezo 7 redakti
- Preparado ekde la miriketino per forigo de tri hidroksilaj grupoj, unu en la 3-a pozicio de la kromenonila ringo kaj du hidroksilaj grupoj en la 3-a kaj 5-a pozicioj de la fenila ringo:
Reakcioj redakti
Reakcio 1 redakti
- Konvertado al apigenino per oksidado de la 2-a karbono de la kromenonila ringo:
Reakcio 2 redakti
- Konvertado al "genisteino" per ŝanĝo de la fenila grupo en la 2-a pozicio de la kromenonila ringo al la 3-a pozicio de la kromenonila ringo:
Reakcio 3 redakti
- Konvertado al luteolino per oksidado de la karbono en la 2-a pozicio de la kromenonila ringo kaj aldono de la hidroksila grupo en la 5-a pozicio de la fenila grupo:
Reakcio 4 redakti
- Konvertado al "prunino" per senhidratigo:
Reakcio 5 redakti
- Konvertado al "akacetino" per anstataŭado de la hidroksila grupo je metoksila grupo en la 4-a pozicio de la fenila grupo kaj oksidado de la karbono en la 2-a pozicio de la kromenonila ringo:
Reakcio 6 redakti
- Konvertado al kverketino per aldono de tri hidroksilaj grupoj, unu en la 3-a pozicio de la kromenonila ringo kaj du hidroksilaj grupoj en la 3-a kaj 5-a pozicioj de la fenila ringo::
Reakcio 7 redakti
- Konvertado al miriketino


