Natria borohidrido
| Natria borohidrido | |||||

| |||||
| Kemia strukturo de la Natria borohidrido | |||||
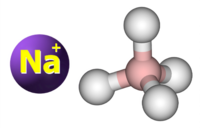 | |||||
| Tridimensia kemia strukturo de la Natria borohidrido | |||||

| |||||
| Vitra boleteto kun natria borohidrido | |||||
| Alternativa(j) nomo(j) | |||||
| |||||
| Kemia formulo | |||||
| CAS-numero-kodo | 16940-66-2 | ||||
| ChemSpider kodo | 26189 | ||||
| PubChem-kodo | |||||
| Fizikaj proprecoj | |||||
| Aspekto | Blankaj higroskopaj kristaloj | ||||
| Molmaso | 37,83 g mol−1 | ||||
| Smiles | [Na+].[BH4-] | ||||
| Denseco | 1,074 g/cm3 | ||||
| Fandopunkto | 400 °C (752 ℉; 673 K)[1] | ||||
| Bolpunkto | 500 °C (932 ℉; 773 K) (malkomponiĝas) | ||||
| Solvebleco | Akvo:550 g/L (25 °C) | ||||
| Mortiga dozo (LD50) |
| ||||
| Ekflama temperaturo | 70 °C (158 ℉; 343 K) °C | ||||
| Sekurecaj Indikoj | |||||
| Risko | R15 R21/22 R23/24/25 R34 R35 R36/38 R43 R42/43 R49 | ||||
| Sekureco | S7/8 S26 S36 S43 S45 | ||||
| Pridanĝeraj indikoj[1] | |||||
| Danĝero
| |||||
| GHS etikedigo de kemiaĵoj | |||||
| GHS Damaĝo-piktogramo |
| ||||
| GHS Signalvorto | Averto | ||||
| GHS Deklaroj pri damaĝoj | H261, H302, H314, H360F | ||||
| GHS Deklaroj pri antaŭgardoj | P201, P231+232, P280, P308+313, P310, P370+378, P402+404 | ||||
(25 °C kaj 100 kPa) | |||||
Natria borohidrido, borohidrido de natrio aŭ NaBH4 estas neorganika komponaĵo, blanka solido kutime trovata kiel pulvoro, kaj diversutila reduktagento kiu trovas aplikojn en kemio, kaj en laboratoria kaj en teknika skalo. Grandaj kvantoj uzatas por blankigo de ligna pulpo. La kombinaĵo estas solvebla en alkoholoj, kaj kelkaj eteroj sed ĝi reakcias kun akvo en la foresto de bazo.
Natria borohidrido reduktas plurajn organikajn karbonilojn kaj ordinare uzatas por konvertado de ketonoj kaj aldehidoj en alkoholojn. Ĝi estas simila al la litia borohidrido, tamen, malpli reakcia. Ĝi same uzatas por reduktiĝo de tioesteroj[2], acilaj[3] kloridoj kaj iminoj[4].
Historio
redaktiLa komponaĵo estis malkovrita kune kun aliaj aluminiaj hidridoj far Hermann Irving Schlesinger (1882-1960) kaj Herbert Charles Brown (1912-2004) ĉirkaŭ 1940, kiu gvidis teamon disvolviĝantan borohidridojn por milito-periodaj aplikoj (aparte en la serĉado de pli volatila kombinaĵo ol urania heksafluorido por uzado en izotopa separado pere de gasdifuzo, tamen ĉi-esplorgrupo ne portis bonsukcesajn rezultojn. Ilia laboro estis senklasita kaj publikigita nur en 1953[5]. H. C. Brown publikigis serion da dek unu dokumentoj pri ilia esploro kune kun H. I. Schlesinger kaj aliaj kunlaborantoj.
Proprecoj
redaktiNatria borohidrido estas senodora blanka ĝis bruna mikrokristala pulvoro, kiu ofte formas glomerulojn. Ĝi povas puriĝi pere de rekristaliĝo de varma duglimo (50 °C)[6]. Natria borohidrido estas solvebla en protonaj solvaĵoj, tiel kiel la akvo kaj alkoholoj kun malaltaj nombroj da karbono. Ĝi reakcias kun ĉi-tiuj solvaĵoj por estigi H2, tamen, ĉi-reakcioj okazas tre malrapidaj. Ĝi komplete malkomponiĝas en neŭtrala aŭ acida akvosolvaĵoj sed ĝi estas stabila kun pH 14. Ĉi-kondiĉoj povas uziĝi por permesi ke la natria borohidrido reakciu laŭ homogena maniero, kun malpliigita vivoperiodo pro ĝia pliigita reakciemo.
Reakcieco
redaktiNaBH4 reduktas multajn organikajn karbonilojn (R-C=O-O-R')[7], depende de la mediaj kondiĉoj. Plej kutime, ĝi uzatas en laboratorio por konvertado de ketonoj kaj aldehidoj en alkoholojn. Ĝi kapabalas redukti acilajn kloridojn, tioesterojn kaj iminojn. Sub neadekvataj kondiĉoj, ĝi ne reduktas esterojn, amidojn aŭ karboksilatajn acidojn. Sub meditemperaturo, la sola acido-derivaĵo kiun ĝi reduktas estas acilaj kloridoj, kiuj estas fortege elektrofilaj.
Multaj aliaj hidrido-reakciantoj estas pli fortaj reduktantoj. Ĝenerale ĉi-tiuj implikas substituado de hidrido per alkilaj grupoj, tiel kiel litia trietil-hidrido kaj litia tri-sek-butil-boro-hidrido, aŭ substituado de B per Al. Variaĵoj en la kontraŭ-jono[8] ankaŭ tuŝas la reakciemon de la borohidrido.
La reakcieco de la NaBH4 povas pliboniĝi aŭ pligrandiĝi fare de gamo da kombinaĵoj. Oksidado de jodo en kvarhidrofurano estigas la kompleksaĵon BH3-THF[9], kiu povas redukti karboksilatajn acidojn. Sammaniere, la sistemo NaBH4-MeOH, estigita per aldono de metanolo al natria borohidrido dum refluo de la kvarhidrofurano, reduktas esterojn al la kunrespondaj alkoholoj.
Miksaĵo de akvo aŭ alkoholo kun borohidrido konvertas parton de ĝi en malstabilan hidrido-esteron, kiu estas pli efika kiel reduktanto, tamen ĝi spontanee malkomponiĝas per estigo de hidrogena gaso kaj boratoj. La sama reakcio povas okazi ankaŭ intramolekule: unu α-ketoestero[10] konvertiĝas en diolon[11], ĉar la alkoholo estigita atakas la borohidridon por produkti unu esteron de la borohidrido, reduktante do la najbaran esteron.
La kombinado de NaBH4 kaj karboksilataj acidoj rezultas en formiĝo de acilo-okso-boro-hidridoj specioj. Ĉi-lastaj povas suferi gamon da reduktiĝoj ne normale asociitaj al la kemio de la borohidrido, tiel kiel alkoholoj al hidrokarbonidoj kaj nitriloj al primaraj aminoj.
Sintezoj
redaktiReakcio 1
redakti- Natria borohidrido preparatas per reakcio inter natria hidrido kaj duborano:
Reakcio 2
redakti- Ĝi same preparatas per reakcio inter natria metoksido kaj duborano:
Reakcio 3
redakti- Natria borohidrido prepariĝas per reakcio de la "metila borato" kun "natria hidrido" sub alta temperaturo:
Reakcio 4
redakti- Natria borohidrido sintezatas pere de reakcio inter natria hidrido kaj bora triklorido aŭ borata anhidrido:
Reakcio 5
redakti- Natria borohidrido uzatas en la sintezo de trialkilboratoj, ekzemple en la produktado de la trietila borato:
Reakcio 6
redakti- Natria borohidrido estas altvalora fonto por la produktado de "borano":
Belegaj prezentaĵoj de Youtube
redakti- Youtube - Catalytic hydrogen generation
- NaBH4 and LiAlH4 Reduction Mechanism Made Easy! | Organic Chemistry
- Why is LiAlH4 Stronger at Reducing than NaBH4? - Organic Chemistry
- Preparation of Alcohols using NaBH4
- Sodium Borohydride Reduction of Vanillin
Literaturo
redakti- Sigma Aldrich
- Chemical Book
- Universitato de Kalifornio en Los Anĝeleso Chemistry and Biochemistry
- Purification of Laboratory Chemicals, W. L. F. Armarego, Christina Li Lin Chai
- Introduction to Organic Laboratory Techniques: A Small Scale Approach, Donald L. Pavia
- Comprehensive Organic Synthesis: Selectivity, Strategy, and Efficiency in ..., Barry M. Trost, Ian Fleming
- Environmental Chemistry of Dyes and Pigments, Harold S. Freeman
Referencoj
redakti- ↑ Chemica Book
- ↑ Tioestero estas tipa estero kie la oksigenatomoj estas anstataŭataj de sulfuratomoj.
- ↑ Acila grupo estas funkcia grupo kie iu hidroxila grupo (OH) estas forigita de iu oksoacido. Acila klorido prezentas la funkcian grupon Cl-C=O-R(adikalo).
- ↑ Imino: estas funkcia grupo aŭ kemia komponaĵo enhavanta karbonan-nitrogenan duoblan ligilon (C=N).
- ↑ Biographical Memoirs, Volume 64, Office of the Home Secretary, National Academy of Sciences
- ↑ Duglimo estas solvaĵo kun alta bolpunkto apartenanta al la grupo dumetila etero de la duetilenoglikolo.
- ↑ Organic Chemistry, Thomas N. Sorrell
- ↑ Kontraŭ-jono estas la jono akompananta jonan specion por tenado de elektra neŭtraleco. Ekzemple: en la kuirsalo aŭ natria klorido la natria katjono estas la kontraŭ-jono de la klora anjono kaj reciproke.
- ↑ Duborano kvarhidrofurano.
- ↑ MCAT Review
- ↑ Diolo estas alkoholo prezentanta duoblan grupon OH.







