Kalia klorato
kemia kombinaĵo
| Kalia klorato | ||||
 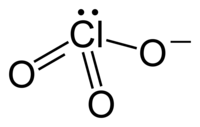 | ||||
| Plata kemia strukturo de la Kalia klorato | ||||
 | ||||
| Tridimensia kemia strukturo de la Kalia klorato | ||||
 | ||||
| Kalia klorato bruligas sukeron. | ||||
 | ||||
| Kalia klorato bruligas karbonon. | ||||
| Alternativa(j) nomo(j) | ||||
| ||||
| Kemia formulo | ||||
| CAS-numero-kodo | 3811-04-9 | |||
| ChemSpider kodo | 18512 | |||
| PubChem-kodo | 6426889 | |||
| Merck Index | 15,7741 | |||
| Fizikaj proprecoj | ||||
| Aspekto | blankaj kristaloj | |||
| Molmaso | 122.545 g·mol−1 | |||
| Denseco | 2.32g cm−3 | |||
| Fandpunkto | 356 °C[1] | |||
| Bolpunkto | 400 °C | |||
| Refrakta indico | 1,4083 | |||
| Ekflama temperaturo | 400 °C | |||
| Solvebleco | Akvo:81.5 g/L | |||
| Mortiga dozo (LD50) | 1870 mg/kg (buŝe)[2] | |||
| Sekurecaj Indikoj | ||||
| Riskoj | R9 R20/22 R51/53 | |||
| Sekureco | S13 S16 S27 S61 | |||
| Pridanĝeraj indikoj | ||||
| Danĝero
| ||||
| GHS Damaĝo Piktogramo |
| |||
| GHS Signalvorto | Averto | |||
| GHS Deklaroj pri damaĝoj | H272, H302, H316, H320, H335, H371, H402, H412 | |||
| GHS Deklaroj pri antaŭgardoj | P210, P220, P221, P260, P261, P264, P270, P271, P273, P280, P301+312, P304+340, P305+351+338, P309+311, P312, P330, P332+313, P337+313, P370+378, P403+233, P405, P501[3] | |||
(25 °C kaj 100 kPa) | ||||
Kalia klorato estas neorganika salo de kalio, kloro kaj oksigeno, kristala blanka pulvoro kun industriaj aplikoj kaj uzata kiel kemia reakcianto. Ĝi estas forta oksidiganto kaj do ĝi uzatas en la produktado de oksigeno en laboratorio, kiel malinfektaĵo, en sekurfosforoj, eksplodaĵoj kaj artfajraĵoj.
Ĝi estas produktita en laboratorio kaj uzata kiel anstataŭanto de la malpli potenca kalia nitrato. Industrie ĝi estas uzata kiel pesticido kaj devas esti zorge manipulita ĉar ĝi eksplode reakcias per frotado aŭ varmigado.
Sintezoj redakti
Sintezo 1 redakti
- Preparado per interagado de la kalia hidroksido kaj kloro:
|
|
Reakcioj redakti
Reakcio 1 redakti
- Klorado de kali malkomponiĝas per varmigado 400 °C al kalia perklorato, kiu siavice malkomponiĝas al kalia klorido kiam temperaturo atingas 550-620 °C.
|
|
Reakcio 2 redakti
- Kalia klorato reakcias kun amonia sulfato en akvo-alkohola solvaĵo por formi amonian kloraton:
|
|
Reakcio 3 redakti
- En ĉeesto de kataliziloj (MnO2, Fe2O3, CuO, ktp), kalia perklorato malkomponiĝas sub temperaturo pli malalta (200 °C):
|
, |
Reakcio 4 redakti
- Kalia klorato povas reduktiĝi per agado kun okzalata acido kaj aldono de sulfata acido kaj tiu reakcio estas uzata por produkti kloran dioksidon en laboratorio:
|
|
Reakcio 5 redakti
- Kalia klorato transformi karbonon en karbonan dioksidon kaj sulfuron en sulfuran dioksidon:
|
|
Reakcio 6 redakti
- En 1816, la aŭstra grafo kaj kemiisto, Friedrich von Stadion (1774-1821), preparis kalian perkloraton traktante la kalian kloraton kun sulfata acido, lasante la miksaĵon resti dum 24 horoj kun ofta agitado, laŭ la jena reakcio:[4]
|
|






