Hipojodita acido
kemia kombinaĵo
| Hipojodita acido | |||
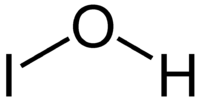
| |||
| Kemia strukturo de la Hipojodita acido | |||

| |||
| 3D Kemia strukturo de la Hipojodita acido | |||
| CAS-numero-kodo | 14332-21-9 | ||
| ChemSpider kodo | 109942 | ||
| PubChem-kodo | 123340 | ||
| Fizikaj proprecoj | |||
| Kemia formulo | |||
| Molmaso | 143.89 g mol−1 | ||
| Smiles | IO | ||
| Acideco (pKa) | 10,64 | ||
| Danĝero
| |||
| GHS etikedigo de kemiaĵoj | |||
| GHS Damaĝo-piktogramo |
| ||
| GHS Signalvorto | Damaĝa substanco | ||
| GHS Deklaroj pri damaĝoj | H400 | ||
| GHS Deklaroj pri antaŭgardoj | P220, P391, P501 | ||
(25 °C kaj 100 kPa) | |||
Hipojodita acido, hipojodito de hidrogeno aŭ HIO estas neorganika malforta oksoacido, kies konjuga bazo estas la hipojodita anjono (IO−). Saloj de hipojodita acido estiĝas per traktado de jodo kun alkaloj, kiu rapide disproporcias estigante jodidojn kaj jodatojn.
I2 + 2 KOH → 2 KIO + H2
Teorie, hipojodita acido estas potenca malinfektilo pro tio ke ĝi prezentas multe da analogio kun la hipoklorita acido. Tre eble ĝi estas la aktiva principo respondeca pri la malinfekteco de parto da jodosolvaĵo uzata en la medicina medio konata kiel jodopovidono.
Sintezoj redakti
Sintezo 1 redakti
Sintezo 2 redakti
- Ĉeeste de hidrarga oksido la sintezo turniĝas plejmulte dekstren kun plej bona rendimento:
Sintezo 3 redakti
- Hipojodita acido estas malstabila kaj makomponiĝas en jodata acido kaj libera jodo:
Sintezo 4 redakti
- Hipojodita acido suferas misproporcion[1] per estigo de jodida acido kaj jodata acido:
Sintezo 5 redakti
- Kunproporcio[2] de jodida acido kaj jodata acido:
Sintezo 6 redakti
Misproporcio de hipojodita acido al jodo kaj jodata acido.
Literaturo redakti
- Inorganic Chemistry, Egon Wiberg, Nils Wiberg
- Inorganic chemistry, E.J. Holmyard
- Chemistry: Principles and Reactions, William Masterton, Cecile Hurley
- Advanced Inorganic Chemistry, Volume 1, Satya Prakash
- Advances in Carbohydrate Chemistry, Volume 3
- Iodine Chemistry and Applications, Tatsuo Kaiho
Mineralaj acidoj redakti
| Halogenidaj acidoj | |||||||
| HF | Fluorida acido | HCl | Klorida acido | HBr | Bromida acido | HI | Jodida acido |
| HFO | Hipofluorita acido | HClO | Hipoklorita acido | HBrO | Hipobromita acido | HIO | Hipojodita acido |
| HFO2 | Fluorita acido | HClO2 | Klorita acido | HBrO2 | Bromita acido | HIO2 | Jodita acido |
| HFO3 | Fluorata acido | HClO3 | Klorata acido | HBrO3 | Bromata acido | HIO3 | Jodata acido |
| HFO4 | Perfluorata acido | HClO4 | Perklorata acido | HbrO4 | Perbromata acido | HIO4 | Perjodata acido |
Referencoj redakti
- ↑ Misproporcio aŭ disproporcio estas tipo de redoksa reakcio en kiu specimeno reduktiĝas kaj oksidiĝas al du malsamaj substancoj.
- ↑ Kunproporcio aŭ kemia interŝanĝo estas procezo kie kemia elemento varias el pluraj oksidiĝaj nombroj al unu sola oksidiĝa nombro.



