Perklorata acido
| Perklorata acido | |||||
| |||||

| |||||
| Alternativa(j) nomo(j) | |||||
| Hidrogena perklorato | |||||
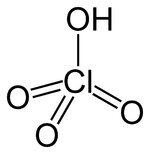
| Kemia formulo | HClO4 | ||||
| PubChem-kodo | 24247 | ||||
| ChemSpider kodo | 22669 | ||||
| CAS-numero-kodo | 7601-90-3 | ||||
| Fizikaj proprecoj | |||||
| Aspekto | senkolora senodora likvaĵo | ||||
| Molmaso | 100.46 g mol−1 | ||||
| Smiles | OCl(=O)(=O)=O | ||||
| Denseco | 1.768 g/cm3 (likva) | ||||
| Fandopunkto | −17 °C (1 ℉; 256 K) (azeotropa) | ||||
| Bolpunkto | 203 °C (397 ℉; 476 K) | ||||
| Solvebleco | Akvo:Tute solvebla | ||||
| Acideco (pKa) | -10 | ||||
| Sekurecaj Indikoj | |||||
| Risko | |||||
| Sekureco | |||||
| Pridanĝeraj indikoj | |||||
| Danĝero
| |||||
| GHS etikedigo de kemiaĵoj[1][2] | |||||
| GHS Damaĝo-piktogramo |
| ||||
| GHS Signalvorto | Damaĝo | ||||
| GHS Deklaroj pri damaĝoj | H271, H290, H302, H314, H373 | ||||
| GHS Deklaroj pri antaŭgardoj | P210, P220, P260, P280, P303+361+353, P304, P305+351+338, P310, P340, P371+380+375 | ||||
(25 °C kaj 100 kPa) | |||||
Perklorata acido aŭ HClO4 estas klora oksoacido, substanco oleeca kaj senkolora, solvebla en akvo kaj akrodora. La kloro de la perklorata acido prezentas oksidastato +7. En koncentriĝoj pli altaj ol 72% ĝi facile eksplodas, tiamaniere ke ĝi malfacile estigeblas pura, do, ĝi estas komercita laŭ ĝia akva solvaĵo maksimume kun koncentriĝo 70%. La perklorata acido estas unubaza acido:
HClO4 • H2O → [H3O]+ + [ClO4]−
Koncentriĝoj pli altaj ol 70% iom post iom okazas formiĝo de "perklorata anhidrido" Cl2O7, kaj sekve oni konstatas eksplododanĝeron per la reakcio:
3 HClO4 → [H3O]+ + [ClO4]− + Cl2O7
Kune kun akvo la perklorata acido formas azeotropan miksaĵon bolanta je 203 °C, en kiu ĉeestas koncentriĝon je 28.4%. Sub ĉi-kondiĉo la acido restas sendifine stabila kaj komerce disponeblas. Ĝiaj solvaĵoj estas higroskopaj, t. e., la solvaĵoj konstante diluiĝos per absorbado de la akvo el la atmosfero, kiam ili ne estas firme enfermita. Ĝi estas forta acido kiam komparata al sulfata acido kaj nitrata acido. Ĝi estas superacido, sed ne tiel forta kiel la acido de Brønsted-Lowry, tiel kiel la fluoroantimona acido aŭ HFSbF5.
Laboratoria preparado
redaktiLa diluita acido estas preparebla per distiliĝo de solvaĵo enhavanta "perkloraton" kun sulfata acido koncentrita.
NaClO4 + H2SO4 → NaHSO4 + HClO4
Laŭ simila metodo, "baria perklorato" reakcias kun sulfata acido diluita por precipiti barian sulfaton, kaj lasante nur perkloratan acidon en la solvaĵo:
Ba(ClO4)2 + H2SO4 → BaSO4 (prec.) + 2HClO4
Industria produktado
redaktiIndustrie la perklorata acido estas produktebla miksante nitratan acidon kun "amonia perklorato". La reakcio estigas nitrozan oksidon aŭ N2O kaj perklorata acido pro sinsekva reakcio de la amonia jono.
HNO3 + NH4ClO4 → N2O + 2 H2O + HClO4
Ĝi estas sintezebla, samkiel ĉiuj perkloratoj, per elektrokemia oksidigo de la klorataj jonoj en acida medio kun aldono de sulfata acido en ĝiaj ĉeloj.
Ĝia formulo estas deduktebla, kaj same ĝi produkteblas, per senpera procezo, sen la uzo de ĝiaj saloj, per la uzo de anoda oksidado de klora solvaĵo kun platina elektrodo.
Proprecoj
redaktiAnhidra perklorata acido estas malstabila oleeca likvaĵo en meditemperaturo. Ĝi estigas almenaŭ kvin hidratoj, pluraj el ili estis kristalografie karakterizitaj. Ĉi-tiuj solidoj konsistas je perklorata anjono ligita pere de hidrogenaj ligoj al nukleoj de la akvo aŭ H3O+. Perklorata acido estigas azeotropan miksaĵon kun akvo, prezentante koncentriĝon ĉirkaŭ 72.5%. Ĉi-formo de la acido estas sendifine stabila kaj komerce disponebla. Senhidratigo de la perklorata acido produktas la anhidridon duklora sepoksido, kiuj estas multe pli danĝera.
2 HClO4 + P4O10 → Cl2O7 + "H2P4O11"
Uzoj
redaktiPerklorata acido estas ĉefe produktita kiel antaŭanto de la "amonia perklorato", uzata kiel raketa fuelo. La kresko de la raketa industrio kondukis al produktadopliigo de perklorata acido. Pluraj milionoj da kilogramoj ĉiujare produktiĝas. Perklorata acido estas unu el la plej uzataj materialoj por gravurado de likvokristalaj ekranoj kaj kritikaj elektronikaj aplikaĵoj samkiel ercoekstraktado krom ekskluzivaj proprecoj pri analiza kemio. Ĝi same estas utila komponaĵo por kromiogravurado.
Perklorata acido estas malforte nukleofila. Aliaj acidoj, kiuj malforte reakcias kun propraj anjonoj, tiel kiel "fuoroborata acido" kaj "sesfluorofosfata acido" povas suferi hidrolizon, dum la perklorata acido ne. Malgraŭ la damaĝoj asociitaj al la eksplodemeco de ĝiaj saloj, la acido estas preferebla en kelkaj sintezoj. Pro la samaj motivoj, ĝi estas utila eluanto[3] uzata en joninterŝanĝo-kromatografio[4].
Sekureco
redaktiPro ĝiaj fortaj oksidigaj proprecoj, perklorata acido submetiĝas al vasta regularo. Ĝi forte reakcias kun metaloj (ekz. aluminio) kaj organika materio (ligno, plastaĵoj). En la 20-a de februaro, 1947, en Los Angeles, Kalifornio, 17 homoj mortis kaj 150 vundiĝis kiam banujo, enhavanta pli ol mil litroj da perklorata acido 75% kaj 25% da "acetata anhidrido" en volumo, eksplodis.
La fabriko, 25 aliaj konstruaĵoj kaj 40 aŭtoj estis detruitaj kaj 250 apudaj domoj estis damaĝitaj. La banjuo estis uzata por meblarfabrikado kun aluminia elektrodeponiĝo. Krom tio, organikaj komponaĵoj estis aldonitaj al la trovarmigita banujo, kiam fera krado estis anstataŭita de alia kovrita per "celuloza acetobuterato"[5]. Post kelkaj minutoj la banujo eksplodis.
Mineralaj acidoj
redakti| Halogenidaj acidoj | |||||||
| HF | Fluorida acido | HCl | Klorida acido | HBr | Bromida acido | HI | Jodida acido |
| HFO | Hipofluorita acido | HClO | Hipoklorita acido | HBrO | Hipobromita acido | HIO | Hipojodita acido |
| HFO2 | Fluorita acido | HClO2 | Klorita acido | HBrO2 | Bromita acido | HIO2 | Jodita acido |
| HFO3 | Fluorata acido | HClO3 | Klorata acido | HBrO3 | Bromata acido | HIO3 | Jodata acido |
| HFO4 | Perfluorata acido | HClO4 | Perklorata acido | HbrO4 | Perbromata acido | HIO4 | Perjodata acido |
Literaturo
redakti- Sigma Aldrich[rompita ligilo]
- Youtube
- Encyclopedia.kids.net Arkivigite je 2016-02-15 per la retarkivo Wayback Machine
- ChemPedia[rompita ligilo]
- Concise Encyclopedia Chemistry, Mary Eagleson
- Encyclopedia of the Alkaline Earth Compounds, Richard C. Ropp
- Van Nostrand’s Scientific Encyclopedia, Douglas M. Considine,Glenn D. Considine
- Encyclopedia of Toxicology, Bruce Anderson, Ann de Peyster, Shayne C. Gad, P.J. Bert Hakkinen, Michael Kamrin, Betty Locey, Harihara M. Mehendale, Carey Pope,Lee Shugart
- Polymeric Materials Encyclopedia, Twelve Volume Set, Joseph C. Salamone
- A Manual for the Chemical Analysis of Metals
- Perchlorate in the Environment, Edward Todd Urbansky
- Environmental Forensics, Ronald E. Hester, Roy M. Harrison, Royal Society of Chemistry (Great Britain)
- Chemistry: An Industry-Based Introduction with CD-ROM, John Kenkel, Paul B. Kelter, David S. Hage
- Practical Pharmaceutical Chemistry - I, Dr. A. V. Kasture, Dr. S. G. Wadodkar, Mr. S. B. Gokhale
- A Comprehensive Guide to the Hazardous Properties of Chemical Substances, Pradyot Patnaik
Vidu ankaŭ
redaktiReferencoj
redakti- ↑ Sigma Aldrich
- ↑ Carl Roth
- ↑ Eluanto estas kemiaĵo uzata por ekstrakti materialon el alia substanco per lavado kun solvaĵo.
- ↑ Joninterŝanĝo-kromatografio estas procezo kiu permesas apartigon de jonoj kaj polaraj molekuloj surbaze de ilia afineco kun la jona interŝanĝanto.
- ↑ Celuloza acetobuterato estas celuloza estero kun malalta viskozeco derivita de la buterata acido.







