Kromatoforo
Kromatoforoj (aŭ pigmentĉeloj) estas pigmento-enhavantaj kaj lumoreflektantaj ĉeloj, kiuj troviĝas en amfibioj, fiŝoj, reptilioj, krustacoj kaj cefalopodoj. Tiuj ĉeloj plejparte estas la kaŭzo de la koloro de la okuloj kaj de la haŭto de malvarmsanguloj. Ili formiĝas en la neŭra kresto dum embria kreskado. Plenkreskaj kromatoforoj estas grupataj laŭ siaj koloroj (pli ĝuste laŭ siaj kolornuancoj) en blanka lumo: flava (ksantoforoj), ruĝa (eritroforoj), iriza (iridoforoj), blanka (leŭkoforoj), bruna/nigra (melanoforoj), kaj blua (cianoforoj). La termino povas ankaŭ referenci al la membrano en iu formo de fotosinteza bakterio.
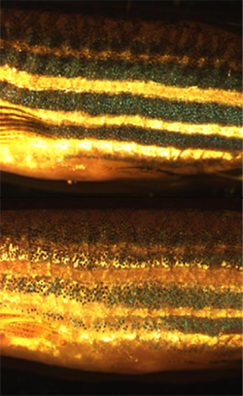
Kelkaj specioj povas rapide ŝanĝi sian koloron per meĥanismoj kiuj movas pigmentojn kaj ŝanĝas la direkton de reflektivaĵoj en kromatoforoj. Tiu procedo, ofte uzata kiel kamuflo, nomiĝas fiziologia koloroŝanĝo. Cefalopodoj kiel la polpo havas malsimplajn kromatoforajn organojn, kontralatajn de muskoloj. Vertebruloj kiel ĥameleonoj faras simile uzante ĉelan signaladon. Tiuj signaloj povas esti hormonoj aŭ nervotransigiloj kaj povas esti kaŭzitaj de ŝanĝiĝoj en humoro, temperaturo, streso, aŭ videblaj ŝanĝiĝoj en la ĉirkaŭamedio.
Malkiel malvarmsanguloj, mamuloj kaj birdoj havas nur unu tipon de kromatoforeca ĉelo: la bruna/nigra. Tiu tipo de kromatoforo en malvarmsanguloj estas studata de sciencistoj por kompreni homan malsanon kaj kiel ilo en medicina malkovro.
Klasifiko
redaktiPigment-enhavantaj ĉeloj de senvertebruloj estis unue priskribitaj kiel chromoforo en itala scienca ĵurnalo en 1819.[1] La termino kromatoforo poste uziĝis por la pigment-enhavantaj ĉeloj devenantaj de la neŭra kresto de malvarmsangulaj vertebruloj kaj cefalopodoj. La vorto fariĝas laŭ la grekaj vortoj khrōma (χρωμα) signifanta "koloro," kaj phoros (φορος) signifanta "enhavanta".
Nur ekde la 1960-aj jaroj la strukturo kaj kolorado de kromotoforoj ekkompreniĝis sufiĉe por krei sistemon de klasifiko laŭ aspekto. Tiu klasifiksistemo samas hodiaŭ, eĉ post pli novaj biokemiaj malkovroj, kiuj estus plej helpa por scienca kompreno de la funkciado de tiuj ĉeloj.[2]
Koloro-produktado havas du kategoriojn: biokromoj kaj skemokromoj. La biokromoj inkluzivas verajn pigmentojn, kiel karotenoidojn kaj pteridinojn. Tiuj pigmentoj elekte absorbas partojn de la videbla spektro kaj lasas aliajn ondolongojn foriri ĝis la okulojn de la rigardanto. Skemokromoj, konataj ankaŭ kiel "strukturaj koloroj", produktadas koloron per reflektado de kelkaj ondolongoj (koloroj) de lumo kaj transiro de aliaj, ĉar ĝi lasas lumondojn perturbi en la strukturo aŭ ĝi disĵetas lumon, kiu falas sur ilin.
Ĉiu kromatoforo enhavas pigmentojn aŭ reflektantajn strukturojn (krom kiam okazis genetika mutacio kiu kaŭzis afekcion kiel albinismon), ne ĉiu pigmenton-enhavanta ĉelo estas kromatoforo. Hemo, ekzemple, estas biokromo kiu kaŭzas la ruĝan aspekton de sango. Ĝi troviĝas principe en eritrocitoj, kiuj formiĝas en la centra parto de la ostoj de organismo tra ĝia tuta vivo, kaj ne dum ĝia embria kreskado. Tial eritrocitoj ne estas kromatoforoj.
Ksantoforoj kaj eritroforoj
redaktiKromatoforoj kiuj enhavas multon da flavaj pteridinaj pigmentoj nomiĝas ksantoforoj (aŭ flavpigmentĉeloj). Kiuj enhavas multon da ruĝaj/oranĝkoloraj karotenoidoj, tiuj estas eritroforoj (aŭ ruĝpigmentĉeloj).[2] Pteridin- kaj karotenoid-enhavantaj veziketoj troviĝas foje en la sama ĉelo, kaj la tuta koloro dependas de la porcio de flavaj kaj ruĝaj pigmentoj.[3] Do, la apartigo inter tiuj kromatoforoj estas pli malpli arbitra. La povo krei pteridinon el guanosina trifosfato estas eco de la plejparto de la kromatoforoj, sed ksantoforoj ŝajnas havi aldonajn vojojn kiuj produktas multon da flava pigmento. Kontraste, karotenoidoj estas metaboligitaj el la manĝaĵoj kaj transportitaj al eritroforoj. Tio estis unue montrata per dono de karoteno-mankanta dieto de griloj al normale verdaj ranoj. La manko de karotenoj en la dieto de ranoj signifis ke la ruĝa/oranĝkolora karotenoida koloro-filtro ne estis en la eritroforoj. Tio kaŭzis bluan koloron ĉe la ranoj anstataŭ ilian normalan verdan koloron.[4]
Iridoforoj kaj leŭkoforoj
redaktiIridoforoj (aŭ irizpigmentĉeloj) estas pigmentaj ĉeloj kiu reflektas lumon uzante platojn de kristalecaj skemokromoj konsistantaj el guanino.[5] Kiam iluminata, ili produktas irizajn kolorojn pro la difrakto de lumo en la plata stako. La orientiĝo de la skemokromo determinas la koloron observatan.[6] Per uzo de biokromoj kiel koloraj filtriloj, iridoforoj kreas optikan efikon konata kiel efiko Tyndall aŭ disĵeto de Rayleigh, kiu produktas brilan bluan aŭ verdan kolorojn.[7] Simila tipo de kromatoforo, la leŭkoforoj (aŭ blankpigmentĉeloj), troviĝas en iuj specioj de fiŝoj. Kiel iridoforoj, ili uzas kristalecajn purinojn por reflekti lumon, kiu donas al iuj fiŝoj brilan blankan kloron. Kiel ksantoforoj kaj eritroforoj, la apartigo inter iridoforoj kaj leŭkoforoj en fiŝoj ne estas ĉiam evidenta, sed ĝenerale iridoforoj produktas irizajn aŭ metalecajn kolorojn, kiam leŭkoforoj produktas blankajn kolornuancojn.[7]
Melanoforoj
redaktiMelanoforoj (aŭ nigraj pigmentĉeloj) enhavas eŭmelaninon, kiu estas tipo de melanino kiu aspektas nigre aŭ malhelbrune pro sia lumabsorbeco. Ĝi estas pakata en veziketoj nomataj melanosomoj kaj disdonata ĉie en la ĉelo. Eŭmelanino estas kreata el tirosino per serio de katalizataj kemiaj reakcioj. Ĝi estas malsimpla kemiaĵo kun pluraj eroj.[8] La principa enzimo en la kreado de melanino estas tirosinazo. Kiam tiu proteino ne funkcias, neniu melanino povas esti kreata, do iuj tipoj de albinismo okazas. En iuj specioj de amfibioj, estas aliaj pigmentoj pakitaj kune kun eŭmelanino. Ekzemple, iu nova pigmento ruĝa estis trovita en la melanoforoj de ranoj phyllomedusine.[9] Verŝajne aliaj specioj havas malsimplajn melanoforajn pigmentojn, sed ankoraŭ veras ke la plejparto de melanoforoj studataj enhavas nur eŭmelaninon.
Homoj havas nur unu tipon de pigmenta ĉelo, la mamula versio de melanoforoj, kiuj produktas la koloron de la haŭto, la haro kaj la okulo. Pro tio, pro ilia abundo, kaj pro ilia kontrasta koloro kiu ebligas facilan observon, melanoforoj estas la plej studataj kromatoforoj. Krome, estas malsamoj inter la biologio de melanoforoj kaj melanocitoj. Melanocitoj povas krei ne nur eŭmelaninon, sed ankaŭ ruĝan/flavan pigmenton nomatan feomelanino.
Cianoforoj
redaktiEn 1995, oni montris ke la helbluaj koloroj en iuj tipoj de mandarinaj fiŝoj ne estas kreataj de skemokromoj. Anstataŭe, la koloro videblas pro cejana biokromo kun nekonata kemia enhavo.[7] Tiu pigmento, kiu troviĝas en la veziketoj de almenaŭ du specioj de fiŝoj callionymid, estas tre nekutima en animaloj, ĉar ĉiu alia blua koloro jam esplorata estas skemokroma. Tial oni proponis novan tipon de kromatoforo, la cianoforo (aŭ blupigmentĉelo). Eblas ke cianoforoj kaj aliaj strangaj tipoj de kromatoforoj troviĝas en aliaj fiŝaj kaj amfibioj. Ekzemple, helaj kromatoforoj kun nekonataj pigmentoj estis vidita en la ranoj kaj dendrobatidae kaj centrolenidae.[10]
Movado de pigmentoj
redaktiPluraj specioj povas movi la pigmenton en kromatoforoj, kaŭzante aspektan koloran ŝanĝiĝon. Tiu procedo, nomata fiziologia koloroŝanĝo, estas studata en melanoforoj, ĉar melanino estas la plej videbla pigmento. En la plejparto de specioj kun relative maldika dermo, la dermaj melanoforoj ofte estas plataj kaj kovras larĝan areon. Tamen, ĉe animaloj kun relative dikaj dermaj tavoloj, kiel plenkreskaj reptilioj, dermaj melanoforoj ofte formas tri-dimensiajn unuojn kun aliaj kromatoforoj. Tiuj dermaj kromatoforaj unuoj (DKU) konsistas el plej alta tavolo de ksantroforoj aŭ eritroforoj, sekve iridofora tavolo, kaj fine korbeca melanofora tavolo kun procesoj kovranta la iridoforojn.[11]
Ambaŭ tipoj de dermaj melanoforoj rolas en fiziologia kolorŝanĝo. Plataj dermaj melanoforoj ofte estas sur aliaj kromatoforoj, do kiam la pigmento estas tra la tuta ĉelo, la haŭto aspektas malhele. Kiam la pigmento estas koncentrita ĉe la mezo de la ĉelo, la pigmentoj en aliaj kromatoforoj reflektas lumon kaj la haŭto havas ilian kolornuancon. Simile, post koncentriĝo de melanino en DKU-oj, la haŭto aspektas verde pro ksantofora (flava) filtrado de disĵeta lumo el la iridofora tavolo. Kiam melanino malkoncentriĝas, la lumo ne plu estas disĵeta, do la haŭto aspektas malhele. Pro tio, ke pigmento movado povas okazi je la aliaj biokromaj kromatoforoj, animaloj kun pluraj tipoj de kromatoforoj povas krei mirigan diversecon de koloroj de haŭto.[12],[13]
La rego kaj meĥaniko de rapida movado de pigmento estis funde studata en pluraj specioj, precipe en amfibioj kaj fiŝoj Teleostei.[14],[7] Estis montrata, ke la procedo povas esti sub la rego de hormonoj, neŭronoj, aŭ ambaŭ. La neŭrokemioj kiuj povas movi pigmenton inkluzivas noradrenalinon, kiu uzas ĝia adrenalina ricevanto kiu troviĝas sur la surfaco de melanoforoj.[15] La principaj hormonoj kiuj participas en la rego de movado ŝajnas esti melanokortino, melatonino kaj melaninon koncentranta hormono (MKH), kiuj estas kreata principe en la hipofizo, pinealo, hipotalamo respektive. Tiuj hormonoj povas ankaŭ esti kreata parakrine de ĉeloj en la haŭto. Oni observis, ke ĉe la surfaco de melanoforoj, hormonoj aktivigas specifajn proteinricevantojn, kiuj irigas la signalon en la ĉelon. Melanokortinoj kaŭzas la disĵeto de pigmento, kiam melatonino kaj MKH kaŭzas ĝia koncentriĝo.[16]
Pluraj melanokortinaj, MKH-aj kaj melatoninaj ricevantoj estas trovitaj en fiŝoj[17] kaj ranoj,[18] inkluzive de homologaĵo (aĵo kun sama strukturo en pluraj malparencaj specioj) de MC1R,[19] kiu estas melanokortina ricevanto kiu regas la haŭtkoloron kaj harkoloron en homoj.[20] En la ĉelo, cAMP estas grava dua mesaĝanto de pigmenta movado. Per meĥanismo ne tute komprenata, cAMP influas proteinojn kiel proteino kinazo A funkciigi molekulajn motorojn veziketon-portantajn laŭlonge de mikrotubetoj kaj mikrofilamentoj.[21],[22],[23]
Adaptiĝo al fono
redaktiLa plejparto de fiŝoj, reptilioj kaj amfibioj, povas iomete fiziologike ŝanĝi sian koloron laŭ sia medio. Tiu speco de kamuflado, konata kiel "fona adaptiĝo", vidiĝas plej ofte kiel malgranda heliĝo aŭ malheliĝo de la haŭto kiu imitas la kolornuancon de la medio. Oni montris ke tiu adapto al fono okazas nur se la animalo povas vidi sian medion,[24] kaj ke movado de melanino en melanoforoj estas la plej grava faktoro en kolorŝanĝo.[16] Kelkaj animaloj, kiel ĥameleonoj kaj polychrotidae-oj, povas tre rapide kaj diverse ŝanĝi sian koloron. Ili povas ŝanĝi sian koloron laŭ temperaturo, humoro, niveloj de streso, socia informo, ne nur por sin adapti al sia medio.
Kreskado
redaktiDum vertrebrula embria kreskado, kromatoforoj estas unu el pluraj specoj de ĉeloj kreataj en la neŭra kresto, kiu estas vico de duopaj ĉeloj ĉe la marĝenoj de la neŭra tubo. Tiuj ĉeloj povas iradi longajn distancojn, kiu ebligas al kromatoforoj ĉeesti en pluraj organoj, kiel la haŭto, la okuloj, la oreloj kaj la cerbo. Forirantaj de la neŭra kresto onde, kromatoforoj eniras la ektodermon dumaniere: aŭ tra malgrandaj truoj en la baza lameno aŭ inter la somitoj kaj la neŭra tubo. Krome, la melanoforoj de la okuloj ne estas el la neŭra kresto, sed el parto de la neŭra tubo kiu kreas optikan tason kaj poste retinon.
Oni nun studas pri kiel kaj kiam la kromatoforaj gepatraj ĉeloj, kromatoblastoj, fariĝas siaj filiaj subtipoj. Oni jam konas, ke ekzemple en zebrafiŝaj embrioj, je tri tagoj post sterkado, jam ĉeestas ĉiu el la ĉelaj tipoj troviĝantaj en la plenkreska fiŝo (melanoforoj, ksantoforoj, kaj iridoforoj). Oni montris kelkajn genojn kiuj regas la malsamigo de kromatoforoj, ekzemple kit, sox10 kaj mitf.[25] Se tiuj proteinoj estas difektitaj, kromatoforoj eble ne ĉeestos en partoj aŭ en la tuta organismo.
Praktikaj aplikoj
redaktiKromatoforoj ne nur estas studataj pro baza esploro por pli plene krompreni kromatoforojn, sed ankaŭ estas praktikaj aplikoj de tiuj ĉi ĉeloj. Ekzemple, zebrafiŝaj larvoj estas uzataj por studi kiel kromatoforoj organiziĝas kaj komunikas por ĝuste krei la striojn kiuj estas sur la plenkreska fiŝo.[26] Tio estas utila modelo por kompreni la aspektojn de animalaj haŭtoj en la fako de evolua kreskada biologio. Kromatofora biologio ankaŭ jam estis uzata por modeli homajn malsanojn kiel albinismo kaj melanomo. Oni antaŭ nelonge montris ke la geno kiu kaŭzas la ora speco de zebrafiŝoj (Slc24a5) havas homan ekvivalenton, kiu korelativas kun haŭtkoloro.[27]
Kormatoforoj ankaŭ estas uzataj kiel biologiaj markiloj de blindeco en malvarmsanguloj, ĉar animaloj kun kelkaj vidaj problemoj ne povas adaptiĝi al la fono en lumaj medioj.[24] Oni pensas, ke homaj homologaĵoj de ricevantoj kiuj helpas pigmentan movadon en melanoforoj influas procedojn kiel malgrandigo de apetito kaj sunbano, do ili fariĝas studendaj por drogoj.[19] Tial drogaj kompanioj kreis teston uzante melanoforoj de la rano Xenopus laevis, kiu identigas eblajn biologie aktivajn kemiaĵojn.[28] Aliaj sciencistoj kreis metodojn kiuj uzas melanoforojn kiel biologiaj sensiloj,[29] kaj por rapida identigo de malsano (laŭ la malkovro ke la toksino pertussis malebligas arigon de pigmentoj en fiŝaj melanoforoj).[30] Estas ankaŭ eblaj militaj aplikoj, kiel kamuflado per kromatoforoj.[31]
Kapopiedulaj kromatoforoj
redaktiKapopieduloj de la subklaso Coleoidea havas malsimplajn plurĉelajn 'organojn', kiujn ili uzas por ŝanĝi sian koloron rapide. Tio estas plej notinda en hele kolorataj kalmaroj, sepioj, kaj polpoj. Ĉiu kromatofora unuo konsistas el unu kromatofora ĉelo kaj pluraj muskolaj, nervaj, kaj gliaj ĉeloj.[32] En la kromatofora ĉelo, pigmentoj estas en elasta sako. Por ŝanĝi koloron, la animalo misformas la sakon per muskoloj, kiu ŝanĝas ĝian translumecon, reflekteblecon aŭ opakecon. Tiu malsamas de la meĥanismo uzata de fiŝoj, amfibioj kaj reptilioj, ĉar la formo de la sako estas ŝanĝata, anstataŭ per movado de pigmentaj veziketoj. Tamen la efikoj estas similaj.
Polpoj uzas kromatoforojn malsimple. Ili povas ŝanĝi sian koloron rapide kaj ondece. Oni pensas ke la nervoj kiuj regas la kromatoforojn estas en la cerbo, en simila sinsekvo kiel la kromatoforoj kiujn ili regas. Tiel, la sinsekvo de kolorŝanĝo similas tiun de neŭrona ago. Eble tial, kiam la neŭronoj agas unu-post-la-alia, la kolorŝanĝo okazas onde.[33] Kiel ĥameleonoj, kapopieduloj uzas fiziologian kolorŝanĝon por socialaj interagoj. Ili ankaŭ estas el la plej lertaj farantoj de fona adaptiĝo, kaj povas tre bone kopii kaj la koloron kaj la teksturon de la medio.
Bakterioj
redaktiKromatoforoj ankaŭ troviĝas en la membranoj de fototrofaj bakterioj. Uzataj principe por fotosintezo, ili enhavas bakterioklorofilajn pigmentojn kaj karotenoidojn.[34] En violaj bakterioj kiel Rhodospirillum rubrum, la lumo-rikoltantaj proteinoj estas ene de la kromatoforaj membranoj. Tamen, en verdaj sulfuraj bakterioj, ili estas en specialigitaj strukturoj nomataj "klorosomoj".[35]
Piednotoj
redakti- ↑ Sangiovanni G. Descrizione di un particolare sistema di organi cromoforo espansivo-dermoideo e dei fenomeni che esso produce, scoperto nei molluschi cefaloso. G. Enciclopedico Napoli. 1819; 9:1–13.
- ↑ 2,0 2,1 Bagnara JT. Cytology and cytophysiology of non-melanophore pigment cells. Int Rev Cytol. 1966; 20:173–205. PMID 5337298
- ↑ Matsumoto J. Studies on fine structure and cytochemical properties of erythrophores in swordtail, Xiphophorus helleri. J Cell Biol. 1965; 27:493–504. PMID 5885426
- ↑ Bagnara JT. Comparative Anatomy and Physiology of Pigment Cells in Nonmammalian Tissues in The Pigmentary System: Physiology and Pathophysiology, Oxford University Press, 1998. ISBN 0-19-509861-7
- ↑ Taylor JD. The effects of intermedin on the ultrastructure of amphibian iridophores. Gen Comp Endocrinol. 1969; 12:405-16. PMID 5769930
- ↑ Morrison RL. A transmission electron microscopic (TEM) method for determining structural colors reflected by lizard iridophores. Pigment Cell Res. 1995; 8:28–36. PMID 7792252
- ↑ 7,0 7,1 7,2 7,3 Fujii R. The regulation of motile activity in fish chromatophores. Pigment Cell Res. 2000; 13:300-19. PMID 11041206
- ↑ Ito S & Wakamatsu K. Quantitative analysis of eumelanin and pheomelanin in humans, mice, and other animals: a comparative review. Pigment Cell Res. 2003; 16:523-31. PMID 12950732
- ↑ Bagnara JT et al. Color changes, unusual melanosomes, and a new pigment from leaf frogs. Science. 1973; 182:1034–5. PMID 4748673
- ↑ Schwalm PA et al. Infrared reflectance in leaf-sitting neotropical frogs. Science. 1977; 196:1225–7. PMID 860137
- ↑ Bagnara JT et al. The dermal chromatophore unit. J Cell Biol. 1968; 38:67–79. PMID 5691979 Kompleta teksto.
- ↑ Palazzo RE et al. Rearrangements of pterinosomes and cytoskeleton accompanying pigment dispersion in goldfish xanthophores. Cell Motil Cytoskeleton. 1989; 13:9–20. PMID 2543509
- ↑ Porras MG et al. Corazonin promotes tegumentary pigment migration in the crayfish Procambarus clarkii. Peptides. 2003; 24:1581–9. PMID 14706537
- ↑ Deacon SW et al. Dynactin is required for bidirectional organelle transport. J Cell Biol. 2003; 160:297-301. PMID 12551954 Kompleta teksto
- ↑ Aspengren S et al. Noradrenaline- and melatonin-mediated regulation of pigment aggregation in fish melanophores. Pigment Cell Res. 2003; 16:59–64. PMID 12519126
- ↑ 16,0 16,1 Logan DW et al. Regulation of pigmentation in zebrafish melanophores. Pigment Cell Res. 2006; 19:206-13. PMID 16704454
- ↑ Logan DW et al. Sequence characterization of teleost fish melanocortin receptors. Ann N Y Acad Sci. 2003; 994:319-30. PMID 12851332
- ↑ Sugden D et al. Melatonin, melatonin receptors and melanophores: a moving story. Pigment Cell Res. 2004; 17:454-60. PMID 15357831
- ↑ 19,0 19,1 Logan DW et al. The structure and evolution of the melanocortin and MCH receptors in fish and mammals. Genomics. 2003; 81:184-91. PMID 12620396
- ↑ Valverde P et al. Variants of the melanocyte-stimulating hormone receptor gene are associated with red hair and fair skin in humans. Nat Genet. 1995; 11:328-30. PMID 7581459
- ↑ Snider J et al. Intracellular actin-based transport: how far you go depends on how often you switch. Proc Natl Acad Sci USA. 2004; 101:13204-9. PMID 15331778 Kompleta teksto Arkivigite je 2008-06-10 per la retarkivo Wayback Machine
- ↑ Rodionov VI et al. Functional coordination of microtubule-based and actin-based motility in melanophores. Curr Biol. 1998; 8:165-8. PMID 9443917 Kompleta teksto Arkivigite je 2008-10-23 per la retarkivo Wayback Machine
- ↑ Rodionov VI et al. Protein kinase A, which regulates intracellular transport, forms complexes with molecular motors on organelles. Curr Biol. 2002; 14:1877–81. PMID 15498498 Kompleta teksto Arkivigite je 2008-10-23 per la retarkivo Wayback Machine
- ↑ 24,0 24,1 Neuhauss SC. Behavioral genetic approaches to visual system development and function in zebrafish. J Neurobiol. 2003; 54:148-60. PMID 12486702. Kompleta teksto[rompita ligilo].
- ↑ Kelsh RN et al. Genetic analysis of melanophore development in zebrafish embryos.] Dev Biol. 2000; 225:277-93. PMID 10985850
- ↑ Kelsh RN. Genetics and evolution of pigment patterns in fish. Pigment Cell Res. 2004; 17:326-36. PMID 15250934
- ↑ Lamason RL et al. SLC24A5, a putative cation exchanger, affects pigmentation in zebrafish and humans. Science. 2005; 310:1782–6. PMID 16357253
- ↑ Jayawickreme CK et al. Use of a cell-based, lawn format assay to rapidly screen a 442,368 bead-based peptide library. J Pharmacol Toxicol Methods. 1999; 42:189-97. PMID 11033434
- ↑ Andersson TP et al. Frog melanophores cultured on fluorescent microbeads: biomimic-based biosensing. Biosens Bioelectron. 2005; 21:111-20. PMID 15967358
- ↑ Karlsson JO et al. The melanophore aggregating response of isolated fish scales: a very rapid and sensitive diagnosis of whooping cough. FEMS Microbiol Lett. 1991; 66:169-75. PMID 1936946
- ↑ Lee I. Nanotubes for noisy signal processing: Adaptive Camouflage PhD Thesis. 2005; University of Southern California. Retrieved June 2006 Arkivigite je 2007-09-27 per la retarkivo Wayback Machine|799 KiB.
- ↑ Cloney RA. & Florey E. Ultrastructure of cephalopod chromatophore organs. Z Zellforsch Mikrosk Anat. 1968; 89:250–280. PMID 5700268
- ↑ Demski LS. Chromatophore systems in teleosts and cephalopods: a levels oriented analysis of convergent systems. Brain Behav Evol. 1992; 40:141-56. PMID 1422807
- ↑ Salton MR. Bacterial membrane proteins. Microbiol Sci. 1987; 4:100-5. PMID 3153178
- ↑ Frigaard NU. & Bryant DA. Seeing green bacteria in a new light: genomics-enabled studies of the photosynthetic apparatus in green sulfur bacteria and filamentous anoxygenic phototrophic bacteria. Arch Microbiol. 2004; 182:265-75. PMID 15340781