Natria bikarbonato
| Natria bikarbonato | ||
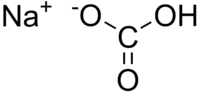
| Plata kemia strukturo de la Natria bikarbonato | ||
| Tridimensia kemia strukturo de la Natria bikarbonato | ||
| Alternativa(j) Nomo(j) | ||
| ||
| Kemia formulo | NaHCO3 | |
| PubChem-kodo | 516892 | |
| ChemSpider kodo | 8609 | |
| CAS-numero-kodo | ||
| Fizikaj proprecoj | ||
| Aspekto | blankaj senodoraj kristaloj | |
| Molmaso | 84.007 g mol−1 | |
| Smiles | [Na+].OC([O-])=O | |
| Denseco |
| |
| Refrakta indico | inter 1,3344 kaj
1,5000 | |
| Fandopunkto | 50 °C (122 ℉; 323 K) (malkomponiĝas al Natria karbonato | |
| Punto de malkomponiĝo |
270 °C (543.15 K) | |
| Acideco (pKa) |
| |
| Solvebleco en akvo |
||
| Solvebleco | ||
| Mortiga dozo (LD50) | 4220 mg/kg (buŝe, muso) | |
| Sekurecaj Indikoj | ||
| Risko | R38 R41 | |
| Sekureco | S22 S24/25 | |
| Pridanĝeraj indikoj | ||
| Danĝero
| ||
| GHS etikedigo de kemiaĵoj | ||
| GHS Damaĝo-piktogramo | ||
| GHS Signalvorto | Averto | |
| GHS Deklaroj pri damaĝoj | H320 | |
| GHS Deklaroj pri antaŭgardoj | P264, P305+351+338, P337+313 | |
Escepte kiam indikitaj, datumoj estas prezentataj laŭ iliaj normaj kondiĉoj pri temperaturo kaj premo (25 °C kaj 100 kPa)
| ||
La Natria bikarbonato aŭ Hidrogenkarbonato de natrio (laŭ IUTAK) estas kemia kombinaĵo kun molekula formulo NaHCO3, kristala blankokolora solido, solvebla en akvo, kaj gusto iomete alkala. Ĝi trovatas en naturo kiel la mineralo nakolito[1]. Ĝi same trovatas en la mineralo natro kaj troviĝas dissolvita en pluraj mineralfontoj. Ĝi enviciĝas en la nutroaldonaĵoj raportitaj de la Eŭropa Unio, identigita per E 500.
Pro tio ke ĝi estas konata ekde la antikveco, ĝiaj saloj estas vaste uzataj kaj por nutraĵo kaj por medicina traktado. En 1835, oni malkovris la kemian fermenton per miksaĵo da tartrata acido kun natria bikarbonato[2]. En 1850, oni anstataŭis la tartratan kremon je fosfata acido monokalcia kun sulfato de alumino kaj natrio, kaj la efekto pliboniĝis proksimume 60%.

Historio
redaktiLa antikvaj egiptoj uzis naturajn demetaĵojn de natro, ia blanka pulvoro konsistanta plejmulte de natria karbonato dekhidratohava kaj natria bikarbonato, kaj estis tre serĉata por la ritoj de enbalzamigo. La pulvoro de natro, trovata per vaporigo de la lagoakvoj, estis uzata por dento- kaj domo- purigado kaj por la ritigita sano de iliaj korpoj. La natro, muelita kaj solvantumita, same estis uzita kiel farbo por hieroglifoj. La natria bikarbonato, trovita en la fontoj de varmakvoj aŭ termofontoj kelkfoje estas nomata salo de Vichy, ĉefe tiu sephidratohava.
En 1791, iu franca kemiisto, Nicolas Leblanc (1742-1806), produktis natrian karbonaton. En 1846, du bakistoj el Novjorko, John Dwight kaj Austin Church, starigis la unuan fabrikon por produktado de natria bikarbonato el natria karbonato kaj karbona dioksido. Ĉi kombinaĵo, nomata kiel saleratus, estas menciita en la romano "Kuraĝaj kapitanoj" de Rudyard Kipling (1865-1936), kiu estis vaste uzata en la 19-a jarcento en la komerca fiŝkaptado por malpermesi la putriĝon de la freŝkaptitaj fiŝoj.
La origino de la nomo bikarbonato devenas el la epoko de Antoine Lavoisier (1743-1794) kiel rezulto de reakcio inter unu metaloksido kun alia nemetaloksido. Tiam, la natria karbonato (Na2CO3), ekzemple, estis skribata Na2O . CO2. Por klarigi la ĉeeston de la hidrogeno, la bikarbonatoj estis konsiderataj saloj unuiĝintaj al unu akvomolekulo, do, la natria hidrogenokarbonato (NaHCO3) estis skribata Na2O . CO2 . 2 H2O kaj konsekvence nomata bikarbonato de natrio. IUTAK antaŭ longe eliminis la ĉi-lastan malnovan nomigon, tamen ankoraŭ komunlingve uzatan.
Produktado
redaktiNaHCO3 estas ĉefe preparita per la Procezo Solvay, malkovrita de la belga kemiisto Ernest Solvay (1838-1922), kies reakciantoj estas natria klorido, amoniako kaj karbona duoksido en akva solvaĵo. Kalcia karbonato uzatas kiel fonto de CO2 kaj la kalcia oksido (CaO) rezultanta uzatas por rekuperi la amoniakon el la amonia klorido. La produkto prezentas malaltan purecon (75%). La pura produkto estiĝas el natria karbonato, akvo kaj karbona duoksido kiel montrita jene. Ĝia jara produktado estas je 100 mil tunoj (2001). NaHCO3 estigeblas per reakcio de karbona duoksido kun akva solvaĵo de natria hidroksido (ankaŭ konata kiel kaŭstika sodo). La komenca reakcio produktas natrian karbonaton.
Sinsekva aldono de karbona duoksido estigas natrian bikarbonaton, kiu en sufiĉe alta koncentriĝo precipitiĝas el la solvaĵo:
Komercaj kvantoj da natria bikarbonato same produktiĝas per simila metodo: la nepura natrierco, minita en la formo de la mineralo evaporito, estas dissolvita en akvo kaj traktita per karbona duoksido. Natria bikarbonato precipitiĝas kiel solido laŭ la ekvacio:
Kemio
redaktiNatria bikarbonato estas amfotera kombinaĵo. Akvaj solvaĵoj estas milde alkalaj pro formado de karbonata acido kaj hidroksida jono:
Natria bikarbonato povas uzati en lavado por forigado de ajna acida nepuraĵo el "kruda" likvaĵo, produktante pli pluran specimenon. Reaction of natria bikarbonato kaj unu acido estigas salon kaj karbonatan acidon, kiu facile malkomponiĝas en karbona duoksido kaj akvo:
Natria bikarbonato reakcias kun acetata acido (trovata en vinagro), estigante natrian acetaton, akvon, and karbona duoksido:
Natria bikarbonato reakcias kun bazoj samkiel natria hidroksido por estigi karbonatojn:
Natria bikarbonato reakcias kun hidroksilaj grupoj de la proteinoj por estigi fortan eferveskon pro la formado de CO2. Ĉi-reakcio uzatas por ĉeestotesto de karboksilaj grupoj en proteinoj.
Varmo-malkomponiĝo
redaktiSupera ol 50 °C, natria bikarbonato laŭgrade malkomponiĝas en natria karbonato, akvo kaj karbona duoksido. La konverto rapidas je 200 °C[3]
Plejmultaj bikarbonatoj suferas ĉi senhidratigan reakcion. Plua varmigo konvertas la karbonaton en natrian oksidon (supera ol 850 °C):[3]
Ĉi-transformoj estas reliefaj por la uzo de NaHCO3 kiel agento por fajroforigo ("BC powder") en kelkaj sekpolvaj fajrestingiloj.
Aplikoj
redaktiPlej ofte sub formo de pulvoro, natria bikarbonato uzatas en procezoj por forigo de farbojn kaj korodaĵojn konata kiel sodo-uragano[4]. La procezo estas aparte adekvata por purigado de aluminiaj paneloj, kiuj povas distordiĝi per aliaj tipoj de erodaj substancoj. Ĝi estas administrebla en naĝejoj, resursoj por maldikigo kaj ĝardenoj kun akvofontoj por plialtigi la nivelojn pri la akvoacideco. Ĝi posedas malfortikajn desinfektajn proprecojn kaj povas aktivi kiel efektiva fungicido kontraŭ kelkaj organismoj, ekzemple en dentopastoj. Ĉar la natria bikarbonato sorbas mucidajn odorojn, ĝi fariĝis efika metodo por la vendistoj de uzitaj libroj ĉar ĝi forigas la malbonodorojn de la malnovaj libroj.
Fajroestingilo
redaktiNatria bikarbonato povas uzati por estingado de etaj elektrofajroj aŭ oleobruloj. Tamen, ĝi ne devas uziĝi en profundaj fritiloj ĉar la oleo povas dissplitiĝi. Natria bikarbonato uzatas en fajroestingiloj kun sekaj kemiaĵoj kiel alternativo anstataŭe de amonia fosfato uzataj en plurcelaj kemipolvaj fajrestingiloj[5]. La alkala naturo de la natria bikarbonato iĝas ĝin la sola agento kun sekpolva kemiaĵo, escepte de la Purpura-K fajroestingilo[6], kiu estis uzita larĝskale en sistemoj pri fajroforigo instalitaj en komercaj kuirejoj. Pro tio ke ĝi povas aktivi kiel alkalo, la agento posedas mildan sapigan efekton per formado de sufokaj sapoŝaŭmoj.
Kuirado
redaktiLa natria bikarbonato, same konata kiel "salo de Vichy", omaĝe al la franca urbo, estas ĉefe uzata en kuirado, kiel fermentiga agento. Ĝi reakcias kun acidaj komponaĵoj en farunmasoj eligante karbonan duoksidon, kaj kaŭzante ekspansion de la maso, donante al ĝi la karakterizan teksturon al la patkukoj, kukoj, rapidaj dolĉaĵoj, sodopano[7], krom aliaj bakaĵoj kaj fritaĵoj. Acidaj komponaĵoj kiuj induktas ĉi-reakcion estas la fosfatoj, tartra kremo[8], citrona suko, jogurto, buterlakto, pulvoro de kakao, vinagro, ktp. Naturaj acidoj en acidpastoj povas fermentiĝi per aldono de etaj kvantoj. La natria bikarbonato povas anstataŭiĝi de bakpulvoro kondiĉe ke sufiĉa acido estu aldonita al la recepto. Multaj formuloj de bakpulvoro posedas natrian bikarbonaton kombinatan kun kalcia fosfato aŭ kremo de tartro.
Kelkfoje, la natria bikarbonato estas uzata en la preparado de vegetaloj, por igi ilin pli molaj, kvankam tiu kutimo iĝis ekstermoda, pro tio ke la plejmulto el la homoj nuntempe preferas pli firmajn vegetalojn. Tamen, ĝi uzatas en la kuirejoj, en Azio kaj Latinameriko, por mildigo de viandoj. Natria bikarbonato reakcieblas kun acidoj de manĝaĵoj, inklude de la Vitamino C. Ĝi ankaŭ uzatas en panfarado samkiel fritaĵoj por plibonigi ties krispeco.
Varmigo de natria bikarbonato produktas eligon de karbona duoksido kiam uzata en bakado. La estigo de karbona duoksido komencas kun temperaturoj superaj al 80 °C. Pro tio ke la reakcio ne okazas en meditemperaturo, miksaĵoj estas lasataj kuŝi sen varmigo ĝis la momento de fornobakado.
Neŭtraligo de acidoj kaj bazoj
redaktiNatria acido estas amfotera substanco, ĉar ĝi reakcias kun acidoj kaj bazoj. Ĝi perforte reakcias kun acidoj, eligante gason CO2 kies reakcia produkto. Natria bikarbonato ne rekomendiĝas por purigado de acidodisverŝoj ĉar la produktita varmo pliigas la acidoreakciecon. La granda kvanto de karbona duoksido estigita forte pliigas la disverŝa areo. Same natria bikarbonato uzeblas por sufokado de etaj bruloj, pro tio ke la varmigo de natria bikarbonato estigas karbonan duoksidon. Granda variaĵo da aplikoj rezultas el ĝiaj neŭtraligaj proprecoj, inklude de malpliigo de disvastigo de la blanka fosforo el fajrokugloj ene de vundoj de soldatoj pafitaj.
Medicinaj uzoj
redaktiNatria bikarbonato miksita kun akvo povas uzati kiel antiacido por trakti stomakan dispepsion kaj pirozon. Ĝi same uzeblas kiel medicina ingredienco en kuraciloj por infanaj stomakdoloroj[9].
Intravejna natria bikarbonato estas akva solvaĵo kelkfoje uzata en kazoj de acidozo, aŭ kiam la bikarbonataj aŭ natriaj jonoj en la sango estas nesufiĉaj. En kazoj de spiracidozo, la bikarbonataj jonoj administritaj devias la bufron acidan/bikarbonatan de la sangoplasmo plialtigante la pH. Estas pro tio ke natria bikarbonato uzatas en medicine kontrolata korpulma revivigo. Infuzaĵo de bikarbonato indikiĝas nur kiam la sanga pH estas forte malalta.
Ĝi same uzatas en traktado kontraŭ hipokaliemio, ĉar ĝi redonas al la ĉeloj la kaliajn jonojn dum periodoj da "hipokloremia metabola alkalozo"[10]. Ĉar natria bikarbonato povas kaŭzi alkalozon, ĝi kelkfoje uzatas por trakti aspirinan trodozon. La aspirino bezonas acidan medion por adekvata absorbiĝo, kaj la baza medio malpliigas la efikecon de la aspirino en kazoj de troa dozo[11]. Natria bikarbonato same uzatas en traktado de "tricikla antideprima trodozo"[12]. Ĝi same aplikiĝas topike kiel pasto, per tri partoj da natria bikarbonato po unu de akvo, por kvietigi kelkajn tipojn de insektaj mordoj kaj pikadoj, samkiel la respektivan ŝviton.
Adversaj reakcioj al administrigo de natria bikarbonato jenas metabola alkalozo[13], edemo pro natria troŝarĝo, kronika kormalfortiĝo[14], hiperosmolara sindromo[15], hipervolumena hipernatremio[16] kaj hipertensio, pro la alta koncentriĝo de natrio. En pacientoj konsumantaj dietojn alte kalciajn kaj laktoriĉajn, kalciajn suplementojn, aŭ antiacidojn kalcihavantajn tiel kiel kalcia karbonata, la uzo de natria bikarbonato povas kaŭzi la alkalan laktosindromon[17], kiu povas rezulti en metastaza kalcigo[18], litiazo[19] kaj rena malfunkcio[20]. Natria bikarbonato povas uzati en la kuracado de alergiaj reakcioj al venenaj plantoj samkiel Toxicodendron radicans, Toxicodendron, Toxicodendron vernix por kvietigi kelkajn asociitajn jukojn.
Natria bikarbonato ankaŭ povas esti utila por forigo de haŭtofragmentojn.
Kelkaj alternativaj fakuloj, tiel kiel Tullio Simoncini[21], promociis natrian bikarbonaton por la kancerokuracado, tamen, la Usona Societo pri Kancero[22] malaprobis kaj pro ties nepruvita efektiveco, kaj pro ties potence alta uzodanĝero.
Literaturo
redakti- Mercola.com
- Encyclopedia.com
- NCBI Resources
- Human Touch of Chemistry[rompita ligilo]
- Cheshire Medical Center[rompita ligilo]
- Encyclopedia of Food and Color Additives, Volume 3, George A. Burdock
- Encyclopedia of Chemical Processing and Design: Volume 59 - Trays versus ..., John J. McKetta Jr
- Encyclopedia of Surface and Colloid Science, Volume 1, P. Somasundaran
- The Kingfisher Science Encyclopedia, Charles Taylor
- Encyclopedia of International Sports Studies, Roger Bartlett, Chris Gratton, Christer G. Rolf
- The Visual Food Encyclopedia, QA International Collectif
- Encyclopedia of Sports & Fitness Nutrition, Liz Applegate, Ph.D.
- Laboratory Inquiry in Chemistry, Richard Bauer, James Birk, Doug Sawyer
- Concise Inorganic Pharmaceutical Chemistry (phar.Che-I), Dr. K. R. Mahadik
- College Practical Chemistry, V K Ahluwalia, Sunita Dhingra, Sunita Dhingra
Vidu ankaŭ
redaktiReferencoj
redakti- ↑ Lacustrine Sandstone Reservoirs and Hydrocarbon Systems: AAPG Memoir 95, Olive W. Baganz, Yuval Bartov, Kevin M. Bohacs, Dag Nummedal
- ↑ Foods & Nutrition Encyclopedia, Two Volume Set, Marion Eugene Ensminger, Audrey H. Ensminger
- ↑ 3,0 3,1 General Chemistry online
- ↑ Sodo-uragano estas procezo, en kiu la natria bikarbonato estas aplikata sur la surfaco pere de kunpremita aero
- ↑ Marine Fire Prevention, Firefighting and Fire Safety: A Comprehensive ..., Maritime Training Advisory Board (U.S.),United States. Maritime Administration, Robert J. Brady Company, National Maritime Research Center (U.S.)
- ↑ Fire Engineering's Handbook for Firefighter I and II
- ↑ Sodopano estas tipo de pano en kiu la fermento estas anstataŭata de natria bikarbonato.
- ↑ Tartra kremo Arkivigite je 2016-04-09 per la retarkivo Wayback Machine estas kalia salo de la tartrata acido.
- ↑ Babylove Arkivigite je 2015-06-11 per la retarkivo Wayback Machine, Robin Barker
- ↑ Medical Toxicology, Richard C. Dart
- ↑ Cloth Diapers, Leah Leverich Ph.D.
- ↑ Avoiding Common Errors in the Emergency Department, Amal Mattu, Arjun S. Chanmugam, Stuart P. Swadron, Carrie Tibbles, Dale Woolridge, Lisa Marcucci
- ↑ Kelley's Essentials of Internal Medicine, H. David Humes
- ↑ Critical Care Nephrology, Claudio Ronco, Rinaldo Bellomo, John A. Kellum
- ↑ Master the Wards: Survive IM Clerkship and Ace the Shelf Arkivigite je 2016-04-07 per la retarkivo Wayback Machine, Conrad Fischer
- ↑ Manual of Nephrology, Robert W. Schrier
- ↑ Ferri's Clinical Advisor 2013: 5 Books in 1, Fred F. Ferri
- ↑ Sodium Bicarbonate[rompita ligilo], Dr. Mark Sircus, paĝo 192
- ↑ Sodium Bicarbonate[rompita ligilo], Dr. Mark Sircus, paĝo 193
- ↑ Medical-Surgical Nursing: Patient-Centered Collaborative Care, Donna D. Ignatavicius, M. Linda Workman
- ↑ Sodium Bicarbonate[rompita ligilo], Dr. Mark Sircus
- ↑ I Survived Metastacised Melanoma Cancer!: Hope For Melanoma Sufferers, Frank E. Burdett